题目内容
某研究性学习小组为测定铜锌合金中铜的质量分数,进行如下实验:取合金10g,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示.求:①稀硫酸中溶质的质量分数.
②合金中铜的质量分数.

【答案】分析:(1)根据锌与硫酸反应的化学方程式,由图中最多生成的氢气质量可以计算出参加反应的硫酸的质量,进而计算出稀硫酸中溶质的质量分数;
(2)根据方程式和氢气的质量可以求得参加反应的锌的质量,进而计算出样品中铜的质量分数.
解答:解:由图示可知,当加入20g稀硫酸时,合金中的锌恰好反应完全,产生0.1g氢气
设参加反应的硫酸的质量为y,合金中锌的质量为x;
Zn+H2SO4═ZnSO4+H2↑
65 98 2
x y 0.1g
则 =
= ,
, =
=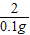 ;
;
解得:x=3.25g,y=4.9 g;
①稀硫酸的溶质质量分数为: ×100%═24.5%;
×100%═24.5%;
②合金中铜的质量为:10g-3.25g=6.75g
则合金中铜的质量分数为: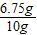 ×100%═67.5%;
×100%═67.5%;
答:稀硫酸的质量分数为24.5%,合金中铜的质量分数为67.5%.
点评:本题主要考查有关化学方程式的计算和质量分数的计算,难度不大.从图象中得到“当加入20g稀硫酸时,合金中的锌恰好反应完全,产生0.1g氢气”的信息是解题的关键.
(2)根据方程式和氢气的质量可以求得参加反应的锌的质量,进而计算出样品中铜的质量分数.
解答:解:由图示可知,当加入20g稀硫酸时,合金中的锌恰好反应完全,产生0.1g氢气
设参加反应的硫酸的质量为y,合金中锌的质量为x;
Zn+H2SO4═ZnSO4+H2↑
65 98 2
x y 0.1g
则
 =
= ,
, =
= ;
;解得:x=3.25g,y=4.9 g;
①稀硫酸的溶质质量分数为:
 ×100%═24.5%;
×100%═24.5%;②合金中铜的质量为:10g-3.25g=6.75g
则合金中铜的质量分数为:
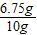 ×100%═67.5%;
×100%═67.5%;答:稀硫酸的质量分数为24.5%,合金中铜的质量分数为67.5%.
点评:本题主要考查有关化学方程式的计算和质量分数的计算,难度不大.从图象中得到“当加入20g稀硫酸时,合金中的锌恰好反应完全,产生0.1g氢气”的信息是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
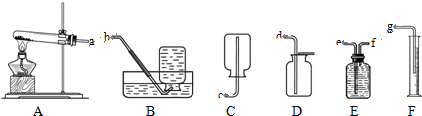
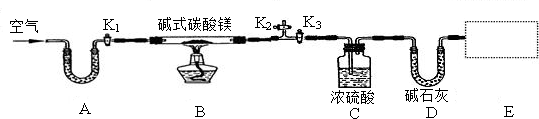
某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分).[已知碱式碳酸镁Mgx(OH)y(CO3)z(x,y,z为正整数)受热易分解,类似碱式碳酸铜,Cu2(OH)2CO3═2CuO+CO2↑+H2O]
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是 ;A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是 .
(2)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加药品和仪器分别是 、 ,其作用是: ,若没有此装置,测得二氧化碳的质量 (填“偏大”、“偏小”或“无影响”).
(3)取22,6g该样品放在研钵中研成粉末放于硬质玻璃管中,研碎的目的是 .
(4)加热前先打开活塞K1,K2,关闭K3,缓缓鼓入空气数分钟,其通空气目的是 _;
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其通空气目的是 .
(6)实验测得数据如下:
从上面表格中得出生成的水质量 g,生成的二氧化碳质量 g,请通过计算推导出该碱式碳酸镁的化学式 (写出计算过程),计算过程:
该碱式碳酸镁受热分解的化学方程式为 .
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是
(2)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加药品和仪器分别是
(3)取22,6g该样品放在研钵中研成粉末放于硬质玻璃管中,研碎的目的是
(4)加热前先打开活塞K1,K2,关闭K3,缓缓鼓入空气数分钟,其通空气目的是
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其通空气目的是
(6)实验测得数据如下:
| 反应前 | 反应后 |
| C装置及药品总质量:87,6g | C装置及药品总质量:89,4g |
| D装置及药品总质量:74,7g | D装置及药品总质量:83,5g |
该碱式碳酸镁受热分解的化学方程式为

某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分).[已知碱式碳酸镁Mgx(OH)y(CO3)z(x,y,z为正整数)受热易分解,类似碱式碳酸铜,Cu2(OH)2CO3═2CuO+CO2↑+H2O]
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是______;A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是______.
(2)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加药品和仪器分别是______、______,其作用是:______,若没有此装置,测得二氧化碳的质量______(填“偏大”、“偏小”或“无影响”).
(3)取22,6g该样品放在研钵中研成粉末放于硬质玻璃管中,研碎的目的是______.
(4)加热前先打开活塞K1,K2,关闭K3,缓缓鼓入空气数分钟,其通空气目的是_______;
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其通空气目的是______.
(6)实验测得数据如下:
从上面表格中得出生成的水质量______g,生成的二氧化碳质量______g,请通过计算推导出该碱式碳酸镁的化学式______(写出计算过程),计算过程:
该碱式碳酸镁受热分解的化学方程式为______ 3MgO+2CO2↑+H2O
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是______;A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是______.
(2)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加药品和仪器分别是______、______,其作用是:______,若没有此装置,测得二氧化碳的质量______(填“偏大”、“偏小”或“无影响”).
(3)取22,6g该样品放在研钵中研成粉末放于硬质玻璃管中,研碎的目的是______.
(4)加热前先打开活塞K1,K2,关闭K3,缓缓鼓入空气数分钟,其通空气目的是_______;
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其通空气目的是______.
(6)实验测得数据如下:
| 反应前 | 反应后 |
| C装置及药品总质量:87,6g | C装置及药品总质量:89,4g |
| D装置及药品总质量:74,7g | D装置及药品总质量:83,5g |
该碱式碳酸镁受热分解的化学方程式为______ 3MgO+2CO2↑+H2O
某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分).[已知碱式碳酸镁Mgx(OH)y(CO3)z(x,y,z为正整数)受热易分解,类似碱式碳酸铜,Cu2(OH)2CO3═2CuO+CO2↑+H2O]
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是______;A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是______.
(2)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加药品和仪器分别是______、______,其作用是:______,若没有此装置,测得二氧化碳的质量______(填“偏大”、“偏小”或“无影响”).
(3)取22,6g该样品放在研钵中研成粉末放于硬质玻璃管中,研碎的目的是______.
(4)加热前先打开活塞K1,K2,关闭K3,缓缓鼓入空气数分钟,其通空气目的是_______;
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其通空气目的是______.
(6)实验测得数据如下:
从上面表格中得出生成的水质量______g,生成的二氧化碳质量______g,请通过计算推导出该碱式碳酸镁的化学式______(写出计算过程),计算过程:
该碱式碳酸镁受热分解的化学方程式为______ 3MgO+2CO2↑+H2O
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是______;A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是______.
(2)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加药品和仪器分别是______、______,其作用是:______,若没有此装置,测得二氧化碳的质量______(填“偏大”、“偏小”或“无影响”).
(3)取22,6g该样品放在研钵中研成粉末放于硬质玻璃管中,研碎的目的是______.
(4)加热前先打开活塞K1,K2,关闭K3,缓缓鼓入空气数分钟,其通空气目的是_______;
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其通空气目的是______.
(6)实验测得数据如下:
| 反应前 | 反应后 |
| C装置及药品总质量:87,6g | C装置及药品总质量:89,4g |
| D装置及药品总质量:74,7g | D装置及药品总质量:83,5g |
该碱式碳酸镁受热分解的化学方程式为______ 3MgO+2CO2↑+H2O
某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分).[已知碱式碳酸镁Mgx(OH)y(CO3)z(x,y,z为正整数)受热易分解,类似碱式碳酸铜,Cu2(OH)2CO3═2CuO+CO2↑+H2O]
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是______;A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是______.
(2)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加药品和仪器分别是______、______,其作用是:______,若没有此装置,测得二氧化碳的质量______(填“偏大”、“偏小”或“无影响”).
(3)取22,6g该样品放在研钵中研成粉末放于硬质玻璃管中,研碎的目的是______.
(4)加热前先打开活塞K1,K2,关闭K3,缓缓鼓入空气数分钟,其通空气目的是_______;
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其通空气目的是______.
(6)实验测得数据如下:
从上面表格中得出生成的水质量______g,生成的二氧化碳质量______g,请通过计算推导出该碱式碳酸镁的化学式______(写出计算过程),计算过程:
该碱式碳酸镁受热分解的化学方程式为______ 3MgO+2CO2↑+H2O
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是______;A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是______.
(2)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加药品和仪器分别是______、______,其作用是:______,若没有此装置,测得二氧化碳的质量______(填“偏大”、“偏小”或“无影响”).
(3)取22,6g该样品放在研钵中研成粉末放于硬质玻璃管中,研碎的目的是______.
(4)加热前先打开活塞K1,K2,关闭K3,缓缓鼓入空气数分钟,其通空气目的是_______;
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其通空气目的是______.
(6)实验测得数据如下:
| 反应前 | 反应后 |
| C装置及药品总质量:87,6g | C装置及药品总质量:89,4g |
| D装置及药品总质量:74,7g | D装置及药品总质量:83,5g |
该碱式碳酸镁受热分解的化学方程式为______ 3MgO+2CO2↑+H2O