题目内容
(2011?平顶山二模)氧化物、酸、碱、盐都是重要的无机化合物.请按要求回答下列一系列相关的问题.(1)产生下列现象,只和空气中的水蒸气有关的是______
A.固体烧碱要密封存放
B.生石灰长期在空气中放置会变质
C.浓硫酸露置于空气中会增重、变稀
D.铁制品放在潮湿空气中会生锈
(2)以下是一些食物的近似pH,对于胃酸过多的人比较适宜的食物是______
| 选项 | A | B | C | D |
| 物质 | 橘子 | 泡菜 | 葡萄 | 玉米粥 |
| pH | 2.9~3.5 | 3.0~4.0 | 3.5~4.5 | 6.8-8.0 |
A.稀释浓硫酸时,为什么不可将水倒进浓硫酸里?请简要解释其原因.
B.盐酸等许多酸都能使紫色石蕊试液变红,为什么?
C.写出用稀盐酸除水垢(主要成分是碳酸钙)的化学方程式.
(4)三支试管中分别装有少量白色固体,它们分别是氯化钠、氢氧化钠、碳酸钙中的一种,只要加入足量的______就能将它们一次性鉴别出来;盐酸(分析纯)化学式HCl质量分数36%密度l.18g/cm3
(5)实验操作考试时某同学做了如下两个实验:①氧化铜与稀硫酸反应;②烧碱溶液与酚酞溶液反应.实验结束后,该同学发现废液缸中有蓝色沉淀.请你写出有蓝色沉淀生成的反应的化学方程式是______.
(6)右图是浓盐酸试剂瓶上标签的部分内容.请回答:
A.现要配制9%的稀盐酸120g,需要这种浓盐酸______g;
B.浓盐酸使用一段时间后溶质质量分数变小的原因是什么?
C.某固体氢氧化钠在空气中敞口放置一段时间后部分变质,将该固体取10g加入质量分数为9%的盐酸至不再产生气泡为止,共产生气体质量为2.2g,试计算未变质的氢氧化钠的质量为多少克?
【答案】分析:(1)分别对各种物质在空气中的变化进行分析判断即可.
(2)胃酸过多的人应多吃一些碱性的食物,来中和胃酸.
(3)A浓硫酸溶于水放出大量的热.B、酸在电离的时候会电离出氢离子.C、碳酸钙与盐酸的反应会生成氯化钙二氧化碳与水.
(4)用水即可区分氯化钠、氢氧化钠、碳酸钙.
(5)蓝色的沉淀也就是氢氧化铜.
(6)A、依据稀释前后溶质的质量不变的知识解决.
B、从浓盐酸的挥发性解决.
C、依据二氧化碳的质量对碳酸钠的质量进行计算可得.
解答:解:(1)分别对各种物质在空气中的变化进行分析可知.
A.固体烧碱要密封存放,是因为它能与二氧化碳反应.
B.生石灰长期在空气中放置会变质,是因为它能与水及二氧化碳反应.
C.浓硫酸露置于空气中会增重、变稀,是因为其吸水性吸收了空气中的水蒸气.
D.铁制品放在潮湿空气中会生锈,是因为铁能与氧气与水蒸气反应的结果.
(2)胃酸过多的人应多吃一些碱性的食物,来中和胃酸,碱性物质的PH大于7.
(3)A浓硫酸溶于水放出大量的热.B、酸在电离的时候会电离出氢离子.C、碳酸钙与盐酸的反应会生成氯化钙二氧化碳与水.
(4)用水即可区分氯化钠、氢氧化钠、碳酸钙,不溶于水的是碳酸钙,溶于水放热的是氢氧化钠,溶于水不放热的是氯化钠.
(5)蓝色的沉淀也就是氢氧化铜,是发生了CuSO4+2NaOH=Cu(OH)2↓+Na2SO4的反应.
(6)A、稀释前后溶质的质量不变所以,需要的浓盐酸的质量=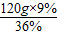 =30g
=30g
B、从浓盐酸的挥发性解决,
C、依据二氧化碳的质量对碳酸钠的质量进行计算可得.
故答案为:(1)C
(2)D
(3)A.水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水沸腾,造成酸液飞溅. B.因为酸溶液中含有较多的氢离子. C.CaCO3+2HCl═CaCl2+H2O+CO2↑
(4)(1)水
(5)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
(6)A.30g
B.浓盐酸有挥发性,HCl挥发后,溶质的质量分数变小
C.解:设未变质的氢氧化钠的质量为x.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
10g-x 2.2g
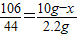
答:未变质的氢氧化钠的质量为4.7g.
点评:此题是一道多点知识考查题,解题的关键是对各相关知识点的掌握与理解,以基础性的知识为主要考查点.
(2)胃酸过多的人应多吃一些碱性的食物,来中和胃酸.
(3)A浓硫酸溶于水放出大量的热.B、酸在电离的时候会电离出氢离子.C、碳酸钙与盐酸的反应会生成氯化钙二氧化碳与水.
(4)用水即可区分氯化钠、氢氧化钠、碳酸钙.
(5)蓝色的沉淀也就是氢氧化铜.
(6)A、依据稀释前后溶质的质量不变的知识解决.
B、从浓盐酸的挥发性解决.
C、依据二氧化碳的质量对碳酸钠的质量进行计算可得.
解答:解:(1)分别对各种物质在空气中的变化进行分析可知.
A.固体烧碱要密封存放,是因为它能与二氧化碳反应.
B.生石灰长期在空气中放置会变质,是因为它能与水及二氧化碳反应.
C.浓硫酸露置于空气中会增重、变稀,是因为其吸水性吸收了空气中的水蒸气.
D.铁制品放在潮湿空气中会生锈,是因为铁能与氧气与水蒸气反应的结果.
(2)胃酸过多的人应多吃一些碱性的食物,来中和胃酸,碱性物质的PH大于7.
(3)A浓硫酸溶于水放出大量的热.B、酸在电离的时候会电离出氢离子.C、碳酸钙与盐酸的反应会生成氯化钙二氧化碳与水.
(4)用水即可区分氯化钠、氢氧化钠、碳酸钙,不溶于水的是碳酸钙,溶于水放热的是氢氧化钠,溶于水不放热的是氯化钠.
(5)蓝色的沉淀也就是氢氧化铜,是发生了CuSO4+2NaOH=Cu(OH)2↓+Na2SO4的反应.
(6)A、稀释前后溶质的质量不变所以,需要的浓盐酸的质量=
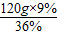 =30g
=30gB、从浓盐酸的挥发性解决,
C、依据二氧化碳的质量对碳酸钠的质量进行计算可得.
故答案为:(1)C
(2)D
(3)A.水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水沸腾,造成酸液飞溅. B.因为酸溶液中含有较多的氢离子. C.CaCO3+2HCl═CaCl2+H2O+CO2↑
(4)(1)水
(5)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
(6)A.30g
B.浓盐酸有挥发性,HCl挥发后,溶质的质量分数变小
C.解:设未变质的氢氧化钠的质量为x.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
10g-x 2.2g
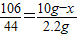
答:未变质的氢氧化钠的质量为4.7g.
点评:此题是一道多点知识考查题,解题的关键是对各相关知识点的掌握与理解,以基础性的知识为主要考查点.

练习册系列答案
相关题目