题目内容
同学们探究过的几个重要实验,仔细观察,回答下列问题:
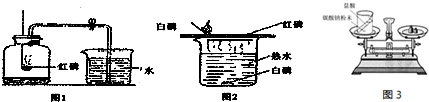
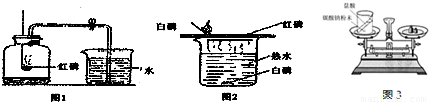
( l )图1是测定空气中氧气含量的实验.在实验过程中,观察到红磷燃烧的现象是:剧烈燃烧、放出大量热和
( 2 )图2是燃烧条件的实验探究. ①铜片上的自磷燃烧,水中的户磷不燃烧,可得出的燃烧条件之一是
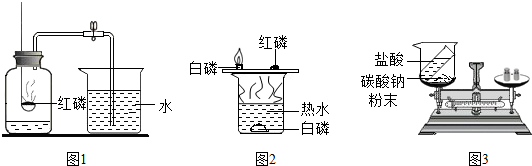
(3)某同学按如图3装置对质量守恒定律进行实验探究,反应前天平平衡,然后将稀盐酸倒入烧杯中与碳酸钠充分反应后,再称量,观察到反应后天平不平衡,天平指针向
由质量守恒定律可知,化学反应前后,一定不变的是
①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质种类.

( l )图1是测定空气中氧气含量的实验.在实验过程中,观察到红磷燃烧的现象是:剧烈燃烧、放出大量热和
产生大量白烟
产生大量白烟
.排除了气密性不好等因素外,过量红磷燃烧熄灭后集气瓶内仍有
仍有
(填”“仍有”或“没有”)残余的氧气.( 2 )图2是燃烧条件的实验探究. ①铜片上的自磷燃烧,水中的户磷不燃烧,可得出的燃烧条件之一是
燃烧需要与氧气接触
燃烧需要与氧气接触
; ②铜片上的自磷燃烧而红磷不燃烧,可得出的燃烧条件之一是温度要达到着火点
温度要达到着火点
.(3)某同学按如图3装置对质量守恒定律进行实验探究,反应前天平平衡,然后将稀盐酸倒入烧杯中与碳酸钠充分反应后,再称量,观察到反应后天平不平衡,天平指针向
右
右
偏转(填“左”或“右”).该反应遵守
遵守
质量守恒定律(填“遵守”或“不遵守”).反应后天平不平衡的原因是产生的二氧化碳气体逸到空气中去了
产生的二氧化碳气体逸到空气中去了
由质量守恒定律可知,化学反应前后,一定不变的是
①②⑤
①②⑤
;(填序号)①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质种类.
分析:(1)该实验中红磷过量的目的就是尽量消耗氧气,但氧气的浓度低到一定的程度白磷就停止燃烧,故熄灭后瓶内仍有氧气.
(2)联系燃烧条件,进行对比分析很容易解答.
(3)根据盐酸与碳酸钠反应生成了二氧化碳气体,逸散到了空气中会使烧杯中物质的质量减少来分析解答.根据化学反应的实质来解释质量守恒的原因.
(2)联系燃烧条件,进行对比分析很容易解答.
(3)根据盐酸与碳酸钠反应生成了二氧化碳气体,逸散到了空气中会使烧杯中物质的质量减少来分析解答.根据化学反应的实质来解释质量守恒的原因.
解答:解:(1)红磷燃烧的现象为:剧烈燃烧、放出大量热和大量白烟.该实验中红磷过量的目的就是尽量消耗氧气,但氧气的浓度低到一定的程度白磷就停止燃烧,故熄灭后瓶内仍有氧气.故填:产生大量白烟;仍有
(2)①铜片上的白磷燃烧,水中的白磷不燃烧,对比可知,水中白磷没有接触氧气,因此燃烧要与氧气接触;②铜片上的白磷燃烧而红磷不燃烧,对比所处环境相同,但红磷的着火点高,故不燃烧,所以燃烧需要温度达到可燃物的着火点.故填:燃烧需要与氧气接触;温度要达到着火点.
(3)盐酸与碳酸钠反应生成氯化钠、水、二氧化碳,而烧杯是敞开的,所以生成的二氧化碳逸散到空气中使质量减小,故指针偏右,但这并不意味着该反应不遵循质量守恒定律;化学反应的实质是分子破裂成原子,原子再重新组合成新的分子,所以反应前后原子的种类没有改变,原子的数目没有增减,原子的质量没有变化,元素的种类、元素的质量、物质的总质量都不变.故填:右;遵守;产生的二氧化碳气体逸到空气中去了;①②⑤
(2)①铜片上的白磷燃烧,水中的白磷不燃烧,对比可知,水中白磷没有接触氧气,因此燃烧要与氧气接触;②铜片上的白磷燃烧而红磷不燃烧,对比所处环境相同,但红磷的着火点高,故不燃烧,所以燃烧需要温度达到可燃物的着火点.故填:燃烧需要与氧气接触;温度要达到着火点.
(3)盐酸与碳酸钠反应生成氯化钠、水、二氧化碳,而烧杯是敞开的,所以生成的二氧化碳逸散到空气中使质量减小,故指针偏右,但这并不意味着该反应不遵循质量守恒定律;化学反应的实质是分子破裂成原子,原子再重新组合成新的分子,所以反应前后原子的种类没有改变,原子的数目没有增减,原子的质量没有变化,元素的种类、元素的质量、物质的总质量都不变.故填:右;遵守;产生的二氧化碳气体逸到空气中去了;①②⑤
点评:从信息资料中获取解决问题的思路和方法,所以要认真分析所给材料的价值,然后结合所给问题进行思考.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
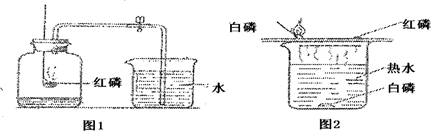
 转(填“左”或“右”)。该反应 质量守恒定律(填“遵守”或“不遵守”)。反应后天平不平衡的原因是
转(填“左”或“右”)。该反应 质量守恒定律(填“遵守”或“不遵守”)。反应后天平不平衡的原因是 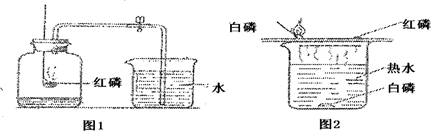
 转(填“左”或“右”)。该反应 质量守恒定律(填“遵守”或“不遵守”)。反应后天平不平衡的原因是
转(填“左”或“右”)。该反应 质量守恒定律(填“遵守”或“不遵守”)。反应后天平不平衡的原因是