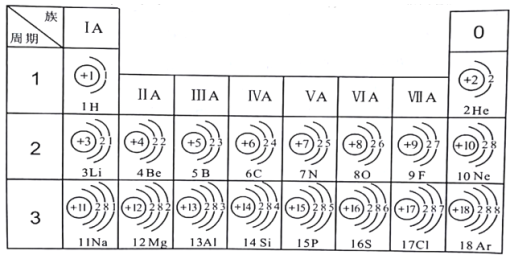
题目内容
【题目】工业上利用软锰矿(主要成分MnO2)制备高锰酸钾的流程如图所示。回答下列问题:(信息提示:MnO2不溶于水,含钾化合物均可溶于水)
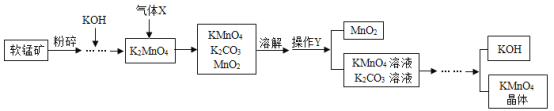
(1)将软锰矿粉碎的目的是______。
(2)流程中通入的气体X是______(填标号)。
A.N2 B.CO2 C.H2
(3)操作Y的名称是______。
(4)上述流程中可循环利用的物质有______。
【答案】增大反应物间接触面积,加快反应速率。 B。 过滤。 KOH、MnO2。
【解析】
(1)根据题干提示信息“反应物接触面积越大,反应速率越快”,和生产的目的,可知将软锰矿粉碎的目的是 增大反应物接触面积,加快反应速率,使软锰矿转化更彻底;
(2)由于锰酸钾和X反应生成了高锰酸钾和碳酸钾以及二氧化锰,根据质量守恒定律可知,参加反应的X一定含有碳元素,所以在给定的物质中应该为二氧化碳;
(3)操作Y,是实现难溶性物质和可溶性物质分离的操作,在实验室中为过滤.在实验室进行该操作时用的玻璃仪器有玻璃棒(引流用)、烧杯(承接用)、漏斗(做过滤器用);
(4)由于在过程中氢氧化钾和二氧化锰作反应物,在过程中也以生成物形式出现,所以这两种物质可以循环使用。

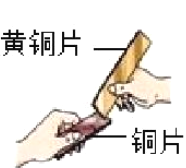
【题目】某兴趣小组想通过实验对铁、铜、锌三种金属的活动性强弱进行探究,现提供的药品有:铁粉、铜丝、锌粒、20%稀硫酸、CuSO4,溶液、ZnSO4溶液、FeSO4溶液同学们分成甲乙两组进行了实验。
(1)甲组同学设计如下方案进行实验:

立刻有同学提出反对,理由是___________。
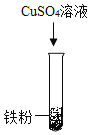
(2)乙组同学设计如下方案进行试验:
实验步骤 |
|
|
实验现象 | 无明显变化 | _____________ |
实验结论 | ________________ | |
发生反应的化学方程式为________________________。
(3)乙组同学将两支试管中的物质倒在一个洁净的烧杯中,发现烧杯内的红色固体明显增多。充分反应后过滤,同学们又对滤渣的成分展开了探究。
(作出猜想)猜想一:滤渣中一定有铜 猜想二:________
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
向滤渣中加入__________ | 有气泡产生 | 猜想二正确 |
此时滤液中含有的溶质是______(填化学式)。
(4)(拓展延伸) 通过学习同学们掌握了比较金属活动性的正确方法,同时又选择了另一组试剂_____,进一步验证了三种金属的活动性强弱。