题目内容
“生活即学习”、“社会即教材”,化学在衣食住行、环境能源、材料科学、医疗卫生等方面越来越大地体现自己的价值.(1)一种焰火火药中所含的硝酸铜在燃放时产生绿色火焰,化学方程式如下:
2Cu(NO3)2
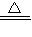 2CuO+O2+4X.其中X是一种空气污染物,其化学式为 .
2CuO+O2+4X.其中X是一种空气污染物,其化学式为 .(2)炼铁的原理是一氧化碳与氧化铁反应,写出其反应的化学方程式为 .
(3)小雨想探究“黄金项链”中是否含有金属铜,她可选用下列试剂中的 .
A.ZnC12溶液 B.Mg(NO3)2溶液 C.H2SO4溶液 D.AgNO3溶液
(4)为探究“物质燃烧的条件”,同时点燃小木条和小煤块,发现小煤块点燃所需时间长,原因是 .
(5)红橙适宜生长在pH为6左右的土壤中.若某土壤的pH为4,经改良后可种植红橙.下列物质中可用来改良土壤酸性的是 .
A.生石灰 B.熟石灰 C.过磷酸钙 D.氢氧化钠.
【答案】分析:(1)根据化学变化前后原子的种类、数目不变,由反应的化学方程式2Cu(NO3)2═2CuO+O2↑+4X↑,推断反应中生成物X的分子构成,根据分子的构成确定X物质的化学式;
(2)由一氧化碳和氧化铁反应生成二氧化碳和铁书写方程式即可;
(3)依据金属与盐溶液反应的规律分析解答;
(4)依据物质间反应以及酸碱性与pH的关系分析解答;
解答:解:(1)由反应的化学方程式2Cu(NO3)2═2CuO+O2↑+4X↑,可得知反应前后各原子的个数为:
反应前 反应后
铜原子 2 2
氮原子 4 0
氧原子 12 4
根据化学变化前后原子的种类、数目不变,生成物X的4个分子中含有4个N原子和8个O原子,则每个X分子由1个N原子和2个O原子构成,物质X的化学式为NO2;
(2)一氧化碳和氧化铁反应生成二氧化碳和铁,方程式为:3CO+Fe2O3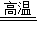 2Fe+3CO2;
2Fe+3CO2;
(3)金属活动性强的金属能够把金属活动性弱的金属从其盐溶液中置换出来,故由于锌、镁的活动性比铜强,所以铜不能与氯化锌和硝酸镁反应,因此不可取,铜的活动性排在氢后,所以铜也不能与稀硫酸反应,因此也不可取,铜的金属活动性比银强,所以铜能置换出硝酸银中的金属,因此可以用来判断“黄金项链”中是否含有金属铜;
(4)酸的pH越大则酸性越弱,所以若要把若某土壤的pH为4变为6的方法是加入显碱性的物质对酸进行消耗;
A、生石灰溶于水能生成碱性的氢氧化钙,但该过程会放出大量的热,所以容易对土壤造成损失,所以不可取;
B、氢氧化钙显碱性,能够中和酸性的土壤,符合题目的要求;
C、过磷酸钙的成分是磷酸二氢钙和硫酸钙混合物,显酸性,不可用来改良土壤酸性;
D、氢氧化钠显碱性,能够消耗酸但其碱性太强,因此不能用于改良酸性土壤;
故选B
故答案为:(1)NO2;(2)3CO+Fe2O3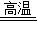 2Fe+3CO2;(3)D;(4)B;
2Fe+3CO2;(3)D;(4)B;
点评:此题是一道多点知识考查题,解题的关键是能够对相关的基础知识有较明确的认识;
(2)由一氧化碳和氧化铁反应生成二氧化碳和铁书写方程式即可;
(3)依据金属与盐溶液反应的规律分析解答;
(4)依据物质间反应以及酸碱性与pH的关系分析解答;
解答:解:(1)由反应的化学方程式2Cu(NO3)2═2CuO+O2↑+4X↑,可得知反应前后各原子的个数为:
反应前 反应后
铜原子 2 2
氮原子 4 0
氧原子 12 4
根据化学变化前后原子的种类、数目不变,生成物X的4个分子中含有4个N原子和8个O原子,则每个X分子由1个N原子和2个O原子构成,物质X的化学式为NO2;
(2)一氧化碳和氧化铁反应生成二氧化碳和铁,方程式为:3CO+Fe2O3
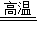 2Fe+3CO2;
2Fe+3CO2;(3)金属活动性强的金属能够把金属活动性弱的金属从其盐溶液中置换出来,故由于锌、镁的活动性比铜强,所以铜不能与氯化锌和硝酸镁反应,因此不可取,铜的活动性排在氢后,所以铜也不能与稀硫酸反应,因此也不可取,铜的金属活动性比银强,所以铜能置换出硝酸银中的金属,因此可以用来判断“黄金项链”中是否含有金属铜;
(4)酸的pH越大则酸性越弱,所以若要把若某土壤的pH为4变为6的方法是加入显碱性的物质对酸进行消耗;
A、生石灰溶于水能生成碱性的氢氧化钙,但该过程会放出大量的热,所以容易对土壤造成损失,所以不可取;
B、氢氧化钙显碱性,能够中和酸性的土壤,符合题目的要求;
C、过磷酸钙的成分是磷酸二氢钙和硫酸钙混合物,显酸性,不可用来改良土壤酸性;
D、氢氧化钠显碱性,能够消耗酸但其碱性太强,因此不能用于改良酸性土壤;
故选B
故答案为:(1)NO2;(2)3CO+Fe2O3
 2Fe+3CO2;(3)D;(4)B;
2Fe+3CO2;(3)D;(4)B;点评:此题是一道多点知识考查题,解题的关键是能够对相关的基础知识有较明确的认识;

练习册系列答案
相关题目

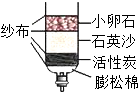
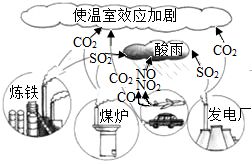

 “生活即学习”、“社会即教材”,化学在衣食住行、环境能源、材料科学、医疗卫生等方面越来越大地体现自己的价值.
“生活即学习”、“社会即教材”,化学在衣食住行、环境能源、材料科学、医疗卫生等方面越来越大地体现自己的价值.
