题目内容
【题目】有一白色固体X,其主要成分是氯化钠,可能含有碳酸钙、氯化钙、硫酸铜和氢氧化钙。为探究其组成进行如下实验,主要流程及现象记录如下:
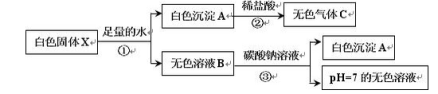
回答下列问题:
(1)根据步骤①实验现象确定白色固体X中一定没有 ;
(2)步骤②中发生反应的化学方程式 ;
(3)步骤③中产生白色沉淀A的化学方程式 ;G
(4)白色固体X中的物质有 ;
【答案】(1)CuSO4
(2)CaCO3 + 2HCl=CaCl2 + H2O +CO2↑
(3)CaCl2 + Na2CO3=CaCO3 ↓ + 2NaCl
(4)NaCl CaCl2 CaCO3
(5) 加水溶解,加入适量的Na2CO3溶液,过滤,向滤液中滴加稀盐酸至不在产生气泡,后蒸发溶液,当有较多固体出现时,停止加热——得到氯化钠固体
【解析】
试题分析∶由题中信息知,样品加水,生成白色沉淀和无色溶液,故无硫酸铜,白色沉淀和盐酸反应生成无色气体,故有由碳酸钙,无色溶液加入碳酸钠溶液,得白色沉淀,故有氯化钙,得PH=7无色溶液,故无氢氧化钙。故⑴白色固体X中一定没有硫酸铜。⑵步骤②中发生反应的化学方程式是CaCO3 + 2HCl=CaCl2 + H2O +CO2↑ (3)步骤③中产生白色沉淀A的化学方程式是 CaCl2 + Na2CO3=CaCO3 ↓ + 2NaCl (4)由此可知,白色固体X中的物质有 NaCl CaCl2 CaCO3 。

练习册系列答案
相关题目
【题目】下列相关说法用微观的知识解释正确的是
选项 | 相关说法 | 解释 |
A | 金刚石硬而石墨软 | 碳原子结构不同 |
B | 高架的电线夏天比冬天长 | 分子间隔随温度的升高而变大 |
C | 二氧化氮和氧气的颜色不同 | 分子的颜色不同 |
D | 一氧化碳和二氧化碳化学性质不同 | 分子结构不同 |