题目内容
世纪是海洋开发与利用的世纪。我省的“十二五”规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。(1)海水淡化:目前淡化海水最常用的方法是_____________▲_____________法。
(2)制盐:
①制粗盐。从卤水中提取粗盐用的结晶方法是 ▲ (“蒸发结晶”或“降温结晶”)。
②粗盐提纯。粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,过滤,然后通过如下操作即可得到较纯的氯化钠:a过滤.b加过量的Ba(OH)2溶液;c加适量的盐酸;d加过量的Na2CO3溶液;e蒸发。正确的操作顺序是 ▲__________ (填字母)。
(3)制碱:氨碱法制纯碱的流程图如下:

①完成图中“( )”的内容:① ▲ ;② ▲ ;③ ▲ 。
②写出由NaHCO3制得Na2CO3的化学方程式:__________________▲________________。
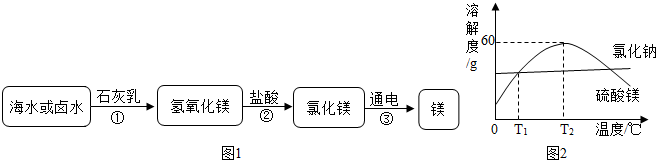
(4)制镁:镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取,主要步骤如下:

①为了使MgCl2转化为Mg(OH)2,试剂①可选用 ▲ ,加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是______▲____ 。
②试剂②可以选用 ▲ ,反应的化学方程式为:___________▲___________。
(1)蒸馏(或多级闪急蒸馏) (2)①蒸发结晶 ②bdace
(3)①氨气(或 );二氧化碳(或
);二氧化碳(或 );加热(或热解)
);加热(或热解)
(4)①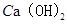 (或氢氧化钙),过滤
(或氢氧化钙),过滤
②稀盐酸, 解析:
解析:
略
(3)①氨气(或
 );二氧化碳(或
);二氧化碳(或 );加热(或热解)
);加热(或热解)(4)①
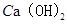 (或氢氧化钙),过滤
(或氢氧化钙),过滤②稀盐酸,
 解析:
解析:略

练习册系列答案
相关题目
 (2012?绍兴)21世纪是海洋开发与利用的世纪.
(2012?绍兴)21世纪是海洋开发与利用的世纪.