题目内容
【题目】(9分)化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸(密度为1.1g/mL)来测定其溶质的质量分数。甲组同学的实验如图1所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌, 溶液pH的变化如图2所示.请回答
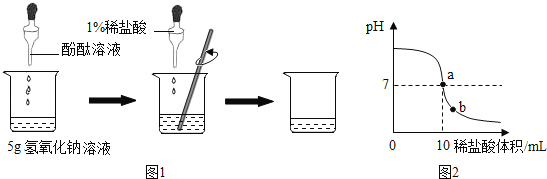
(1)a点溶液中大量存在的离子有__________
(2)b点溶液中的溶质有__________________
(3)计算氢氧化钠溶液中溶质的质量分数。(保留一位小数)
【答案】(1)Na+ 、 Cl-- (2) NaCl、HCl (3) 2.4﹪
【解析】
试题分析:(1)图2中a点表示溶液刚好呈中性,说明氢氧化钠和稀盐酸恰好完全反应,则此时溶液中含有大量的钠离子和氯离子;
(2)b点表示溶液呈酸性,说明加入的稀盐酸过量,则此时溶液中含有溶质为 NaCl、HCl;
(3)根据图示可知,消耗HCl的质量=10mL×1.1g/mL×1﹪=0.11g;再利用化学方程式进行计算即可。
解:设氢氧化钠溶液中溶质的质量分数为x (1分)
NaOH + HCl ==== NaCl + H2O (2分)
40 36.5
5x 0.11g (1分)
40:/5x ===36.5/0.11g (1分)
X==2.4﹪ (1分)
答:氢氧化钠溶液中溶质的质量分数为2.4﹪

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目