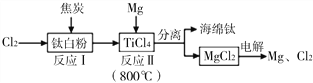
题目内容
【题目】雾霾严重影响人们的生活和健康。某地区的雾霾中可能含有如下可溶性物质NH4NO3、NaNO3、BaCl2、MgCl2、Na2SO4。某同学收集了该地区的雾霾,经必要的处理后得到试样溶液,设计并完成了下图所示实验。
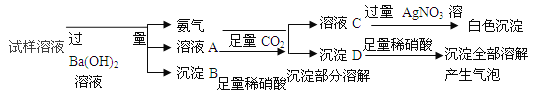
根据以上实验操作与现象,该同学得出的结论不正确的是
A.试样溶液中可能含有NaNO3和BaCl2
B.沉淀D的化学式为BaCO3
C.试样溶液中一定含有NH4NO3、MgCl2、Na2SO4
D.该实验中涉及的化学反应不一定是复分解反应
【答案】A
【解析】
试题分析:原试样是溶液,故首先判断BaCl2和Na2SO4不能共存(因为两者会反应生成白色沉淀),然后根据在试样溶液中加入过量的Ba(OH)2溶液,产生氨气,说明原试液中含有NH4NO3,同时得到沉淀B,根据原试样溶液中的成分,可能是MgCl2和Ba(OH)2反应生成的或Na2SO4和Ba(OH)2反应生成的,在所得沉淀中加入足量的稀硝酸,结果沉淀部分溶解,可判断既有Mg(OH)2沉淀,又有BaSO4沉淀,说明原试样溶液中含有MgCl2、Na2SO4,一定不含BaCl2,至于溶液A中加入足量的CO2出现的沉淀,是过量的Ba(OH)2和CO2反应生成的碳酸钡(这个反应不是复分解反应),故加入稀硝酸沉淀全部溶解且有气泡生成,可能含有NaNO3,故选A

 名校课堂系列答案
名校课堂系列答案【题目】为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中都加入了11g样品及足量的水配成溶液;②向三个烧杯中加入质量不等的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到wg的白色固体.实验数据如下:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入CaCl2的质量/g | 5.55 | 12 | 15 |
W/g | 5 | 10 | 10 |
回答下列问题:
(1)将烧杯Ⅲ中的溶液蒸干,得到 g固体,该固体由 和 组成(只填化学式).
(2)样品中碳酸钠的质量分数是多少?