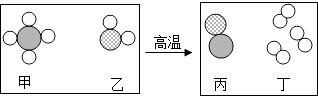
题目内容
【题目】根据要求回答问题:
(1)用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?方程式为:3CO+Fe2O3 ![]() 2Fe+3CO2 . (结果精确到0.1)
2Fe+3CO2 . (结果精确到0.1)
(2)某化学小组在实验室用CO和Fe2O3在密闭容器中隔绝空气加强热模拟炼铁过程,一段时间后收集到如表数据:
物质 | CO | Fe2O3 | Fe | M | CO2 |
反应前质量(g) | 2.8 | 16 | 0 | 0 | 0 |
反应后质量(g) | 0 | 0 | 0 | a | b |
①预期看到的实验现象应该是;
②实验过程中看到的实验现象与预期的现象相符.但查阅资料可知:CO还原Fe2O3时在一定条件下可生成铁的其它氧化物FeO和Fe3O4 , 二者也均为黑色固体,发生的化学反应方程式分别为Fe2O3+CO ![]() 2FeO+CO2、 .
2FeO+CO2、 .
③表中b的值为;物质M的化学式为 .
【答案】
(1)解:设理论上可炼出含铁96%的生铁质量为x.
Fe2O3+3CO | 2Fe+3CO2 |
160 | 112 |
1000t×80% | 96%x |
![]()
x=583.3t.
(2)红色固体变成黑色固体;3Fe2O3+CO ![]() 2Fe3O4+CO2;4.4; FeO
2Fe3O4+CO2;4.4; FeO
【解析】解:(2)①由于碳与氧化铁在高温时反应生成了铁和二氧化碳,预期看到的实验现象应该是:红色固体变成黑色固体;(2)CO还原Fe2O3时在一定条件下可生成Fe3O4和二氧化碳,发生的化学反应方程式是:3Fe2O3+CO ![]() 2Fe3O4+CO2.(3)设生成的二氧化碳的质量为x,由元素质量守恒可知:
2Fe3O4+CO2.(3)设生成的二氧化碳的质量为x,由元素质量守恒可知:
CO~ | CO2 |
28 | 44 |
2.8g | x |
![]()
x=4.4g
Fe2O3中铁元素的质量为16g× ![]() ×100%=11.2g
×100%=11.2g
生成的M中氧元素的质量为:16g× ![]() ×100%﹣(4.4g﹣2.8g)=3.2g.
×100%﹣(4.4g﹣2.8g)=3.2g.
生成的M中铁原子、氧原子的个数比为: ![]() =
= ![]()
所以,物质M的化学式为FeO.
答案:(1)理论上可以炼出含铁96%的生铁的质量为583.3t.(2)①红色固体变成黑色固体;②3Fe2O3+CO ![]() 2Fe3O4+CO2;③4.4;FeO.
2Fe3O4+CO2;③4.4;FeO.
【考点精析】本题主要考查了质量守恒定律及其应用的相关知识点,需要掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏才能正确解答此题.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案