题目内容
【题目】高氯酸钠晶体(NaClO4H2O)可用于制备高氯酸。粗盐除去泥沙等不容性杂质后得到“精盐”(只含MgCl2、CaCl2两种杂质),以“精盐”为原料制备高氯酸钠晶体的流程如下:
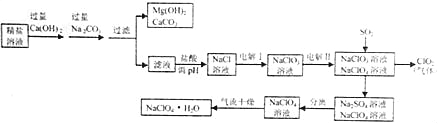
【资料】高氯酸钠在较高温度下容易分解。
请回答下列问题:
(1)滤液中溶质除NaCl外还含有 。
(2)ClO2中氧元素的化合物是 。
(3)通入SO2是为了除去NaClO4溶液中少量的NaClO3,该反应的化学方程式为 。
(4)“气流干燥”时温度应控制在75°C~95°C之间,其原因是 。
【答案】
(1)Na2CO3
(2)﹣2
(3)SO2+2NaClO3=Na2SO4+2ClO2
(4)温度过高,高氯酸钠晶体失去结晶水或高氯酸钠分解,温度过低,干燥不充分
【解析】
试题分析:
(1)粗盐溶液中加入过量的氢氧化钙是为了除净镁离子,加入过量的碳酸钠,是为了除净钙离子,此时滤液中有氯化钠还是剩余的碳酸钠;故填:Na2CO3;
(2)ClO2中氧元素的化合价是﹣2价;故填:﹣2;
(3)二氧化硫与氯酸钠反应生成硫酸钠和二氧化氯,故填:SO2+2NaClO3=Na2SO4+2ClO2;
(4)因为高氯酸钠在较高温度下容易分解或失去结晶水,温度过低,干燥不充分;所以“气流干燥”时温度应控制在75°C~95°C之间,故填:温度过高,高氯酸钠晶体失去结晶水或高氯酸钠分解,温度过低,干燥不充分。

练习册系列答案
相关题目