题目内容
农村使用的氮肥有硫酸铵[(NH4)2SO4]和尿素[CO(NH2)2]等.(1)尿素中碳、氧、氮、氢元素的质量比为________;(2)当硫酸铵、尿素中所含氮元素质量相同时,所含氢元素的质量比是________.
解:(1)尿素的化学式为CO(NH2)2,则尿素中碳、氧、氮、氢元素的质量比12:16:(14×2):(1×4)=3:4:7:1.
(2)(NH4)2SO4中氮元素的质量分数为: ×100%=21.2%,氢元素的质量分数为:
×100%=21.2%,氢元素的质量分数为: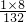 ×100%=6.1%;
×100%=6.1%;
尿素中氮元素的质量分数为: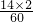 ×100%≈46.7%,氢元素的质量分数为
×100%≈46.7%,氢元素的质量分数为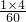 ×100%=6.7%;
×100%=6.7%;
设所含氮元素的质量相同时,硫酸铵的质量为A,尿素的质量为B,
则 ×A=
×A=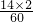 ×B
×B
解得:A:B=11:5;
则硫酸铵、尿素中所含氢元素的质量比为(11×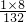 ):(5×
):(5×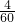 )=2:1.
)=2:1.
故答案为:
(1)3:4:7:1;
(2)2:1.
分析:(1)根据尿素的化学式,利用各元素的质量比为各元素相对原子质量和的比来计算尿素中碳、氧、氮、氢元素的质量比即可;
(2)先根据元素的质量分数公式分别计算出硫酸铵和尿素中氮元素的质量分数,然后假设硝酸铵和尿素的质量,根据所含氮元素的质量相同列出方程式,即可计算出硫酸铵和尿素的质量比;根据元素的质量分数公式分别计算出硫酸铵和尿素中氢元素的质量分数,利用氢元素的质量分数和硫酸铵和尿素的质量比即可求得氢元素的质量比.
点评:主要考查了元素质量分数的求法以及利用相对质量求物质中所含元素的比值的方法,这些基本计算要求掌握.某元素的质量分数=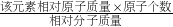 ×100%.
×100%.
(2)(NH4)2SO4中氮元素的质量分数为:
 ×100%=21.2%,氢元素的质量分数为:
×100%=21.2%,氢元素的质量分数为: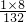 ×100%=6.1%;
×100%=6.1%;尿素中氮元素的质量分数为:
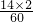 ×100%≈46.7%,氢元素的质量分数为
×100%≈46.7%,氢元素的质量分数为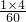 ×100%=6.7%;
×100%=6.7%;设所含氮元素的质量相同时,硫酸铵的质量为A,尿素的质量为B,
则
 ×A=
×A=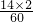 ×B
×B解得:A:B=11:5;
则硫酸铵、尿素中所含氢元素的质量比为(11×
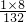 ):(5×
):(5×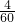 )=2:1.
)=2:1.故答案为:
(1)3:4:7:1;
(2)2:1.
分析:(1)根据尿素的化学式,利用各元素的质量比为各元素相对原子质量和的比来计算尿素中碳、氧、氮、氢元素的质量比即可;
(2)先根据元素的质量分数公式分别计算出硫酸铵和尿素中氮元素的质量分数,然后假设硝酸铵和尿素的质量,根据所含氮元素的质量相同列出方程式,即可计算出硫酸铵和尿素的质量比;根据元素的质量分数公式分别计算出硫酸铵和尿素中氢元素的质量分数,利用氢元素的质量分数和硫酸铵和尿素的质量比即可求得氢元素的质量比.
点评:主要考查了元素质量分数的求法以及利用相对质量求物质中所含元素的比值的方法,这些基本计算要求掌握.某元素的质量分数=
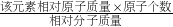 ×100%.
×100%. 
练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
农村经常使用氮肥硝酸铵(化学式为NH4NO3),今有一硝酸铵样品经过测定含氮量为37%,已知该化肥中只含有一种杂质,则该化肥中可能混有下列物质中的哪种氮肥( )
| A、氯化铵(NH4Cl) | B、硫酸铵[(NH4)2SO4] | C、尿素[CO(NH2)2] | D、碳铵(NH4HCO3) |