题目内容
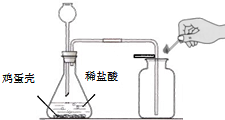 (2010?松江区一模)小张同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下实验探究.
(2010?松江区一模)小张同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下实验探究.【实验过程】小张同学组装了右图装置.将鸡蛋壳洗净、干燥并捣碎后放入锥形瓶里,加入足量的稀盐酸充分反应(假设其他杂质不与盐酸反应).测得相关数据如下所示:
鸡蛋壳(12.5g)+稀盐酸(40.5g)
| 至质量不减少 |
【数据处理】
(1)根据质量守恒定律,反应生成二氧化碳的质量为
4.4
4.4
g.(2)请用化学方程式计算鸡蛋壳中碳酸钙的物质的量是多少?并求此蛋壳中碳酸钙的质量分数是多少?(写出计算过程)
【实验反思】
用该装置制取二氧化碳,反应进行较长时间后,小张用燃着的火柴放在集气瓶口,火焰仍不熄灭.请从实验装置上分析,你认为原因是
长颈漏斗下端管口无液封,气体从长颈漏斗逸出
长颈漏斗下端管口无液封,气体从长颈漏斗逸出
.分析:【数据处理】(1)鸡蛋壳中所含碳酸钙与盐酸反应放出二氧化碳使反应后剩余的混合物质量减小,根据质量守恒定律,剩余的混合物质量减小的量即反应放出二氧化碳的质量;
(2)根据碳酸钙与盐酸反应的化学方程式,由放出二氧化碳的质量计算出反应所消耗碳酸钙的质量,该质量即所取鸡蛋壳样品中所含量碳酸钙质量,由此可求得此蛋壳中碳酸钙的质量分数;
【实验反思】用燃着的火柴放在集气瓶口,火焰仍不熄灭,可判断没收集满二氧化碳,造成此现象的原因之一有装置漏气;观察图中装置,可发现长颈漏斗的不正确使用是产生装置漏斗的明显原因.
(2)根据碳酸钙与盐酸反应的化学方程式,由放出二氧化碳的质量计算出反应所消耗碳酸钙的质量,该质量即所取鸡蛋壳样品中所含量碳酸钙质量,由此可求得此蛋壳中碳酸钙的质量分数;
【实验反思】用燃着的火柴放在集气瓶口,火焰仍不熄灭,可判断没收集满二氧化碳,造成此现象的原因之一有装置漏气;观察图中装置,可发现长颈漏斗的不正确使用是产生装置漏斗的明显原因.
解答:解:【数据处理】(1)根据质量守恒定律,反应生成二氧化碳的质量=12.5g+40.5g-48.6g=4.4g
(2)设该鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 4.4g
=
x=10g
鸡蛋壳中碳酸钙的物质的量=
=0.1mol
此蛋壳中碳酸钙的质量分数=
×100%=80%
答:鸡蛋壳中碳酸钙的物质的量是0.1mol,该鸡蛋壳中碳酸钙的质量分数为80%.
【实验反思】用燃着的火柴放在集气瓶口,火焰仍不熄灭,至少可说明没有收集满二氧化碳,造成此现象的原因之一是由于图中装置中长颈漏斗未伸入液面以下,导致产生的二氧化碳气体从长颈漏斗逸出.
故答案为:长颈漏斗下端管口无液封,气体从长颈漏斗逸出.
(2)设该鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
鸡蛋壳中碳酸钙的物质的量=
| 10g |
| 100g/mol |
此蛋壳中碳酸钙的质量分数=
| 10g |
| 12.5g |
答:鸡蛋壳中碳酸钙的物质的量是0.1mol,该鸡蛋壳中碳酸钙的质量分数为80%.
【实验反思】用燃着的火柴放在集气瓶口,火焰仍不熄灭,至少可说明没有收集满二氧化碳,造成此现象的原因之一是由于图中装置中长颈漏斗未伸入液面以下,导致产生的二氧化碳气体从长颈漏斗逸出.
故答案为:长颈漏斗下端管口无液封,气体从长颈漏斗逸出.
点评:本题对实验的数据处理及意外原因分析进行考查,解答时需要较强的数据分析能力及实验的基本技能.

练习册系列答案
相关题目
