题目内容
【题目】将一定量氯化镁和氯化钠的固体混合物加水配成145.8g的溶液,向所得溶液中加入一定浓度的氢氧化钠溶液,加入氢氧化钠溶液的质量与反应后溶液的质量关系如图.计算: 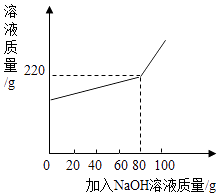
(1)所用氢氧化钠溶液的溶质质量分数.
(2)恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是多少?
【答案】
(1)解:设参加反应的氢氧化钠质量为x,氯化镁质量为y,生成氯化钠质量为z,
反应生成氢氧化镁的质量为:145.8g+80g﹣220g=5.8g,
2NaOH+ | MgCl2═ | Mg(OH)2↓+ | 2NaCl |
80 | 95 | 58 | 117 |
x | y | 5.8g | z |
![]() =
= ![]() =
= ![]() =
= ![]() ,
,
x=8g,y=9.5g,z=11.7g,
所用氢氧化钠溶液的溶质质量分数为: ![]() ×100%=10%,
×100%=10%,
答:所用氢氧化钠溶液的溶质质量分数为10%
(2)解:恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是:220g×10%﹣11.7g+9.5g=19.8g,
答:恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是19.8g
【解析】向所得溶液中加入一定浓度的氢氧化钠溶液时,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,加入80g氢氧化钠溶液时恰好完全反应,根据反应的化学方程式及其提供的数据可以进行相关方面的计算.

练习册系列答案
 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
