题目内容
20℃时,将一铁块放入92g CuSO4溶液中,充分反应后,铁块有剩余,经称量铁块质量增加1.6g,剩下的溶液保持温度不变蒸发10g水,析出不含结晶水的固体0.4g,则:
(1)求析出Cu的质量.
(2)求剩下溶液中的溶质在20℃时的溶解度.
解:设生成的铜的质量是X克,生成的硫酸亚铁的质量是Y,参加反应的铁的质量是Z.
CuSO4+Fe═FeSO4+Cu-------△m
56 152 64 (64-56)
Z Y X 1.6g
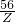 =
=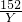 =
=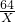 =
=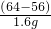
Z=11.2g
Y=30.4g
X=12.8g
∴根据质量守恒定律可知,反应后溶剂的质量=92g+11.2g-30.4g-12.8g=60g.
∵保持温度不变,蒸发溶液后有固体析出,说明蒸发后的溶液已经饱和,则蒸发后溶液中的溶质的质量=30.4g-0.4g=30g,溶剂的质量=60g-10g=50g.
设20℃时硫酸亚铁的溶解度为X,根据质量守恒定律可得关系式:
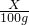 =
=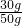 得:X=60g.
得:X=60g.
析出Cu的质量为12.8克,剩下溶液中的溶质在20℃时的溶解度为60g
分析:写出化学方程式并代入数据计算即可得到铜的质量和硫酸亚铁的质量,然后根据溶解度的概念计算溶解度.
点评:学会利用质量的变化值进行计算,理解溶解度的概念和应用.
CuSO4+Fe═FeSO4+Cu-------△m
56 152 64 (64-56)
Z Y X 1.6g
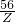 =
=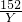 =
=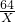 =
=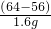
Z=11.2g
Y=30.4g
X=12.8g
∴根据质量守恒定律可知,反应后溶剂的质量=92g+11.2g-30.4g-12.8g=60g.
∵保持温度不变,蒸发溶液后有固体析出,说明蒸发后的溶液已经饱和,则蒸发后溶液中的溶质的质量=30.4g-0.4g=30g,溶剂的质量=60g-10g=50g.
设20℃时硫酸亚铁的溶解度为X,根据质量守恒定律可得关系式:
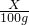 =
=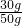 得:X=60g.
得:X=60g.析出Cu的质量为12.8克,剩下溶液中的溶质在20℃时的溶解度为60g
分析:写出化学方程式并代入数据计算即可得到铜的质量和硫酸亚铁的质量,然后根据溶解度的概念计算溶解度.
点评:学会利用质量的变化值进行计算,理解溶解度的概念和应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目