题目内容
【题目】某炼铁厂,用Fe2O3的质量分数为80%的赤铁矿为原料炼铁,若每天生产含杂质2%的生铁1120t.问需要赤铁矿石多少吨?
【答案】含杂质2%的生铁1120t含铁的质量是:1120t×(1-2%)=1097.6t;
设需要赤铁矿石的质量为x,
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
160112
80%x1097.6t
![]()
x=1960t
答:需要赤铁矿石1960t
【解析】含杂质2%的生铁1120t含铁的质量是:1120t×(1-2%)=1097.6t;
设需要赤铁矿石的质量为x,
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
160 112
80%x 1097.6t
![]()
x=1960t
答:需要赤铁矿石1960t
点睛∶这是一道有关含杂质的计算题,根据化学方程式计算,首先把含杂物变为纯净物,再代入化学方程式进行计算。

【题目】化学实验是学习化学的基础,请根据下图回答问题:
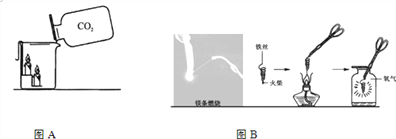
⑴如图A,把二氧化碳气体沿烧杯壁慢慢倒入,观察到的现象是下层蜡烛先熄灭。因此,由这一性质决定的二氧化碳的用途是灭火。
⑵如图B分别取直径相同的镁条和铁丝各15cm,观察它们与氧气反应的现象,记录如下:
物质 | 镁 条 | 铁 丝 |
现象 | 在空气中点燃后,剧烈燃烧,发出耀眼白光。 | 在空气中不燃烧;将铁丝绕成螺旋状并在末端系一根火柴,点燃火柴后,放入氧气中,铁丝剧烈燃烧,火星四射。 |
选择相同长度和直径的上述两种金属做实验的目的是______________,在螺旋状铁丝的末端系一根火柴的作用是____________,写出铁丝在氧气中发生反应的化学方程式_______________________________,此反应属于________________________(填基本反应类型)。瓶中要预先加少量水或铺一层细沙的目的是________________;铁丝在氧气中燃烧的现象为___________________________。