题目内容
【题目】区分下列各组物质,所用的试剂或方法正确的是
A. 高锰酸钾和氯酸钾——观察颜色 B. 硬水和软水——闻气味
C. 黄铜片和纯铜片——相互刻画 D. CO2和N2——燃着的木条
【答案】AC
【解析】A、氯酸钾是白色粉末,高锰酸钾是紫红色粉末,可根据颜色鉴别,正确;B、硬水和软水都是无色无味的液体,不能用闻气味的方法鉴别,错误;C、黄铜片是铜锌合金,硬度强于铜片,可以采用相互刻画的方法鉴别,正确;D、二氧化碳和氮气都不会支持燃烧,燃着的木条伸入集气瓶中都会熄灭,现象相同,不能鉴别,错误。故选AC。

【题目】碱式碳酸镁高温能分解,可用于镁盐制备,制药工业等.其组成一般以xMgCO3yMg(OH)2zH2O表示. 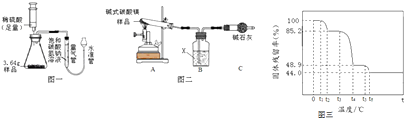
(1)研究其分解产物 (i)取样高温灼烧,检测到有二氧化碳和水生成,充分反应后,得到白色固体,由此推断生成物中肯定不含金属镁及单质碳,理由是 .
(ii)检验生成物中是否含有碳酸镁、氢氧化镁.
操作现象 | 结论 | |
① | 取适量生成物置于试管中, . | 生成物中不含碳酸镁. |
② | 取适量生成物置于试管中,加入热水,滴入酚酞试液,观察到现象. | 生成物中不含氢氧化镁. |
(iii)用酚酞试液检验是否存在氢氧化镁不能用冷水代替热水是因为 . 综合上述实验推断碱式碳酸镁的分解产物为二氧化碳、水和 .
(2)测定碱式碳酸镁中碳元素的质量分数 按图一进行实验.
①量气管中装有饱和碳酸氢钠溶液,不能用水代替是因为 , 若用稀盐酸代替稀硫酸,则测出碳元素的质量分数将(填“偏大”、“偏小”或“无影响”).
②实验中共消耗稀硫酸20mL,根据所测数据求得生成气体的质量为1.32g,则进入量气管的气体体积为 , 碳元素的质量分数为 . (实验条件下CO2密度为1.97g/L)
(3)确定碱式碳酸镁的组成 设计如图二装置,并按下述步骤操作.
步骤1:检查装置的气密性,将36.4g样品置于试管中,称量装置B的质量为192g.
步骤2:加热装置A直至样品完全反应.
步骤3:用止水夹夹紧装置A和装置B间胶皮管,停止加热,冷却至室温.
步骤4:称量装置B的质量为199.2g.
(i)装置B中物质为 , 装置C的作用为 . 判断样品完全反应的方法:当观察到装置B中 , 则样品已完全反应.
(4)(ii)根据上述实验数据求出碱式碳酸镁的化学式,写出计算过程.
(5)有人说“加热碱式碳酸镁最后阶段固体质量减少是因为生成二氧化碳”是真的吗? 另取一定量碱式碳酸镁样品在空气中加热,测出样品的固体残留率( ![]() ×100%)随温度的变化如图三所示,请回答下列问题.
×100%)随温度的变化如图三所示,请回答下列问题.
①0至t1过程中固体质量保持不变的原因是 .
②分析图像数据判定该说法是(填“真的”或“假的”),判定理由是