题目内容
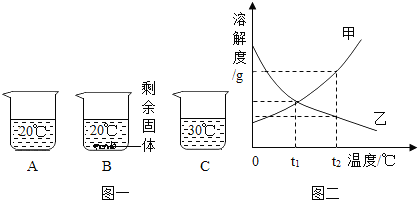
向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示。
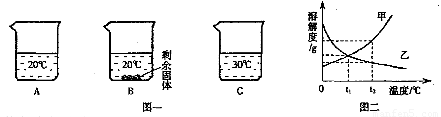
(1)烧杯中的溶液一定属于饱和溶液的是??? (填序号);
(2)图二能表示NaNO3溶解度曲线的是??? (填“甲”或“乙”);
(3)欲除去混在甲中的少量乙物质将可采用的方法是??? ;
(4)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的??? (填序号)。
A.甲、乙都是饱和溶液??????? B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙????????? D.溶质质量分数:甲>乙
【答案】
(1)B
(2)甲
(3)降温结晶
(4)B、D
【解析】
试题分析:(1)饱和溶液是不能继续溶解该溶质的溶液,B中有固体剩余,故一定是饱和溶液;
(2)由图1可知,NaNO3的溶解度随温度的升高而增大,故应是曲线甲;
(3)由于甲的溶解度随温度的变化变化较大,故可采用降温结晶;
(4)从t2℃降温到t1℃,甲的溶解度变小,有晶体析出,溶液的质量变小;乙的溶解度变大,变成不饱和溶液,无晶体析出,溶液的质量不变;由于降温后甲的溶解度大于t2℃乙的溶解度,故甲的溶质质量分数大于乙。
考点:溶解度曲线

练习册系列答案
相关题目