题目内容
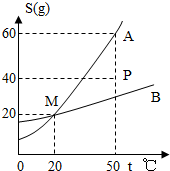 如图是A、B两物质的溶解度曲线,回答下列问题:
如图是A、B两物质的溶解度曲线,回答下列问题:(1)图中P点表示B物质的
(2)50℃时,A物质的饱和溶液中,A物质的质量分数为
(3)小明不小心在A物质中混了少量的B物质,但他通过所学知识将A物质又变纯净了,你觉得他使用的方法是:
(4)50℃时,在200g水中加入了90gA物质,完全溶解后,要将其变成饱和溶液①采用加溶质的方法,要再加
(5)当处于P状态的A溶液发生下列变化时(其它条件不变),试参考示例分析P点的运轨迹.例:
①升高温度:向右平移;
②增加溶剂:
分析:(1)固体溶解度曲线上及曲线上方的点都表示该温度下的饱和溶液,溶解度曲线下方的点表示的是该温度下的不饱和溶液;
(2)由50℃时,A物质溶解度,可以计算A物质的质量分数;
(3)由A的溶解度受温度的影响的变化趋势,可以确定结晶析出的方法;
(4)由由50℃时,A物质溶解度,可以计算200g水中最多溶解A物质的质量,进而判断加溶质或蒸发溶解的质量及降温至20℃析出A晶体的质量;
(5)饱和溶液与不饱和溶液可通过改变温度、增减溶剂或溶质的方法实现互相转化,溶液状态的变化就使得曲线图中的点做相应地移动.对于溶解度随温度升高而增大的物质而言:点的平行左右移动,是温度变化的结果,平行左移到一定温度会达饱和,此时若还继续温度的变化,点将会沿曲线向下移动;点的垂直上下移动,是增减溶剂或溶质的结果,垂直上移至曲线上时,点就不在继续移动.
(2)由50℃时,A物质溶解度,可以计算A物质的质量分数;
(3)由A的溶解度受温度的影响的变化趋势,可以确定结晶析出的方法;
(4)由由50℃时,A物质溶解度,可以计算200g水中最多溶解A物质的质量,进而判断加溶质或蒸发溶解的质量及降温至20℃析出A晶体的质量;
(5)饱和溶液与不饱和溶液可通过改变温度、增减溶剂或溶质的方法实现互相转化,溶液状态的变化就使得曲线图中的点做相应地移动.对于溶解度随温度升高而增大的物质而言:点的平行左右移动,是温度变化的结果,平行左移到一定温度会达饱和,此时若还继续温度的变化,点将会沿曲线向下移动;点的垂直上下移动,是增减溶剂或溶质的结果,垂直上移至曲线上时,点就不在继续移动.
解答:解:(1)P点在B的溶解度曲线的上方,故P点表示B物质的饱和溶液;
(2)50℃时,A物质的溶解度为60g,故其饱和溶液中溶质的质量分数为
×100%=37.5%;
(3)A的溶解度受温度的影响较大,要从含有少量B的A溶液中得到较多的A晶体,通常可采用降温结晶的方法;
(4)50℃时,A物质的溶解度为60g,故200g水中最多溶解A物质120g,完全溶解后,要将其变成饱和溶液:①采用加溶质的方法,要再加30gA物质;②90gA物质能溶解在150g水中形成饱和溶液,故采用蒸发溶剂的方法,需恒温蒸发50g水;③20℃时,A物质的溶解度为20g,故200g水中最多溶解A物质40g,采用降温的方法也能达到饱和,降温至20℃,则析出A晶体的质量为50g;
(5)升高温度,A溶液的组成及状态不变,仅是溶液温度升高,所以P点平行右移;增加溶剂,使不饱和的A溶液距离饱和越来越远,所以P点将垂直向下平移.
故答案为:(1)饱和;(2)37.5%;(3)降温结晶;(4)①30;②50;③50;(5)平行右移;垂直向下平移.
(2)50℃时,A物质的溶解度为60g,故其饱和溶液中溶质的质量分数为
| 60g |
| 60g+100g |
(3)A的溶解度受温度的影响较大,要从含有少量B的A溶液中得到较多的A晶体,通常可采用降温结晶的方法;
(4)50℃时,A物质的溶解度为60g,故200g水中最多溶解A物质120g,完全溶解后,要将其变成饱和溶液:①采用加溶质的方法,要再加30gA物质;②90gA物质能溶解在150g水中形成饱和溶液,故采用蒸发溶剂的方法,需恒温蒸发50g水;③20℃时,A物质的溶解度为20g,故200g水中最多溶解A物质40g,采用降温的方法也能达到饱和,降温至20℃,则析出A晶体的质量为50g;
(5)升高温度,A溶液的组成及状态不变,仅是溶液温度升高,所以P点平行右移;增加溶剂,使不饱和的A溶液距离饱和越来越远,所以P点将垂直向下平移.
故答案为:(1)饱和;(2)37.5%;(3)降温结晶;(4)①30;②50;③50;(5)平行右移;垂直向下平移.
点评:主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.要理解溶解度曲线图中的点的移动,是由于溶质、溶剂或温度的改变的发生的,水平移动仅温度改变,上下移动溶液组成在改变.

练习册系列答案
相关题目
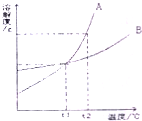 如图是A、B两物质的溶解度曲线,下列说法错误的是( )
如图是A、B两物质的溶解度曲线,下列说法错误的是( )| A、温度大于t1℃时,A的溶解度大于B的溶解度 | B、t1℃时,A、B两饱和溶液的溶质质量分数相等 | C、A、B两物质的溶解度都随温度升高而增大 | D、t2℃时,等质量的A、B两饱和溶液降温到t1℃,析出溶质的质量相等 |

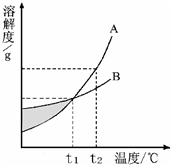 6、如图是A、B两物质的溶解度曲线,分析曲线得到的下列信息中,正确的是( )
6、如图是A、B两物质的溶解度曲线,分析曲线得到的下列信息中,正确的是( ) (2009?鞍山)如图是A、B两物质的溶解度曲线示意图.
(2009?鞍山)如图是A、B两物质的溶解度曲线示意图.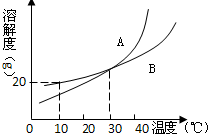 如图是A、B两物质的溶解度曲线图.请回答:
如图是A、B两物质的溶解度曲线图.请回答: