题目内容
【题目】某粗盐样品中含有钙、镁的氯化物和硫酸钠等杂质,以下是提纯该样品的流程图。
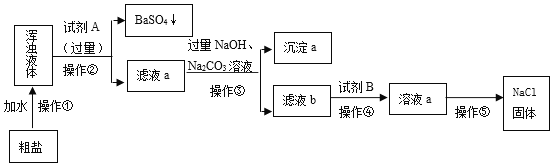
请回答:
(1)“操作②”中,需要用到的玻璃仪器有烧杯、玻璃棒、____;“试剂A”的化学式为___。
(2)判断所加“试剂A”是否过量的具体操作是_______________________________。
(3)加入NaOH溶液的目的是____________,反应的化学方程式为_________________。
(4)“沉淀a”的组成是______________________________(填化学式)。
(5)“操作⑤”中要使用玻璃棒,其作用是__________________________。
【答案】 漏斗 BaCl2 静置片刻后,取少量上层清液于试管中,滴加BaCl2溶液(或稀硫酸),观察现象【或,取少量滤液a于试管中,滴加BaCl2溶液(或稀硫酸),观察现象】 除去滤液a中的MgCl2(或Mg2+) MgCl2 + 2NaOH =2NaCl + Mg(OH)2↓ Mg(OH)2、CaCO3、BaCO3(多写MgCO3也可) 搅拌,防止在加热过程中局部温度过高,造成液滴飞溅
【解析】根据所学知识和题中信息知,(1)“操作②”过滤中,需要用到的玻璃仪器有烧杯、玻璃棒、漏斗;“试剂A”的化学式为BaCl2 与硫酸钠反应生成氯化钠和硫酸钡沉淀。(2)判断所加“试剂A”是否过量的具体操作是静置片刻后,取少量上层清液于试管中,滴加BaCl2溶液(或稀硫酸),观察现象,有沉淀生成说明量不足,没有沉淀生成说明恰好完成反应或过量。(3)加入NaOH溶液的目的是除去滤液a中的MgCl2 ,NaOH溶液和MgCl2反应生成氯化钠和氢氧化镁沉淀;反应的化学方程式为MgCl2 + 2NaOH =2NaCl + Mg(OH)2↓。(4)“沉淀a”的组成是Mg(OH)2、CaCO3、BaCO3(多写MgCO3也可),钙、镁的氯化物和硫酸钠与过量氯化钡反应后,滤液a中有氯化钙,氯化镁,氯化钠,氯化钡;滤液B中有氯化钠,氢氧化钠,碳酸钠。(5)“操作⑤”蒸发结晶中要使用玻璃棒,其作用是搅拌,防止在加热过程中局部温度过高,造成液滴飞溅。
点睛∶掌握粗盐提纯的基本操作,方法和步骤是对学生的基本要求。在提纯过程中掌握适当的药品和恰当的量至关重要。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案【题目】M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学欲探究M与铜、铝的活动性顺序,请你和他们一起进行以下探究活动.
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
【猜想与假设】小敏的猜想是Al>Cu>M;小强的猜想是Al>M>Cu;你的猜想是 。
【设计与实验一】小莉取M丝、铜丝、铝丝和编号为①、②、③的3支试管,进行如表的实验(试管中均盛有体积相同、溶质质量分数也相同的稀盐酸);
实验操作 | M丝插入试管①中 | 钢丝插入试管②中 | 铝丝插入试管③中 | 实验结论 |
刚开始的现象 | 有少量气泡产生 | 无气泡 | 无气泡 | M>Cu: |
几分钟后的现象 | 有少量气泡产生 | 无气泡 | 有大量气泡产生 |
|
【交流与表达】同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因,该原因是 。
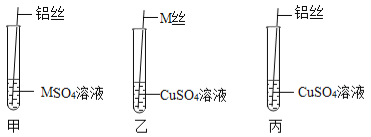
【设计与实验二】为了进一步探究三种金属的活动性顺序,同学们取粗细相同,打磨干净的M丝、铝丝及相关溶液,又进行了如图所示的实验:
(1)试管乙中观察到的现象是 。
(2)试管丙中反应的化学方程式为 。
【交流与表达】同学们经讨论后认为该实验可以优化,去掉试管 (填试管编号)中的实验,也可以得出正确的结论。
【解释与结论】通过以上实验,同学们得出了三种金属的活动性顺序。
【评价与反思】实验结束后,同学们对实验过程进行了如下反思:
(1)影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还有 (任写一种)
(2)探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据 进行判断(任写一种)