题目内容
化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定。甲、乙两同学各提出不同的测定方法:
(1)甲同学:酸碱中和法
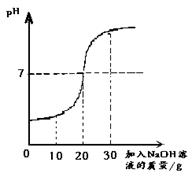
取60g废水于烧杯中,逐渐滴入溶质质量分数为10%的NaOH溶液(反应的化学方程式为:H2SO4+2NaOH==Na2SO4+ 2H2O),反应过程溶液pH变化如右图,求60g废水中H2SO4的质量。
(2)乙同学:沉淀分析法
改用BaCl2溶液代替NaOH溶液测定废水中的H2SO4的含量(反应的化学方程式为:H2SO4+ BaCl2==BaSO4↓+2HCl),你认为结果会 (填“偏高”、“偏低”、“不变”)理由是 。
(1)甲同学:酸碱中和法
取60g废水于烧杯中,逐渐滴入溶质质量分数为10%的NaOH溶液(反应的化学方程式为:H2SO4+2NaOH==Na2SO4+ 2H2O),反应过程溶液pH变化如右图,求60g废水中H2SO4的质量。

(2)乙同学:沉淀分析法
改用BaCl2溶液代替NaOH溶液测定废水中的H2SO4的含量(反应的化学方程式为:H2SO4+ BaCl2==BaSO4↓+2HCl),你认为结果会 (填“偏高”、“偏低”、“不变”)理由是 。
(1) 2.45g
(2)偏高(1分) BaCl2溶液也会与废水中的Na2SO4反应。(2分)
(2)偏高(1分) BaCl2溶液也会与废水中的Na2SO4反应。(2分)
(1)当PH=7时,溶液呈中性,说明两者恰好完全反应,此时加入的NaOH溶液的质量为20克。
解:设废水中硫酸的质量为x
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 20g×10%
98/80=X/20g×10% (2分)
X=2.45g (1分)
答:废水中硫酸的质量为2.45g
(2)偏高,因为 BaCl2溶液也会与废水中的Na2SO4反应。
解:设废水中硫酸的质量为x
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 20g×10%
98/80=X/20g×10% (2分)
X=2.45g (1分)
答:废水中硫酸的质量为2.45g
(2)偏高,因为 BaCl2溶液也会与废水中的Na2SO4反应。

练习册系列答案
相关题目