题目内容
已知相同温度和压强下,气体的体积比等于气体的分子个数比.在20℃,101kPa条件下,将12L O2与8L CO和H2的混合气体相混合,使其完全燃烧后恢复到原来的温度和压强.(1)若剩余气体的体积是12L,则原混合气体中V(CO)=
(2)若剩余气体的体积是V L,则原混合气体中
| V(CO) | V(H2) |
(3)若剩余气体的体积为V L,则V的取值范围是
分析:可以根据化学方程式进行计算、分析和判断,从而得出正确的结论.例如,根据化学方程式可以判断反应物和生成物之间的分子个数比.
解答:解:(1)解设一氧化碳的体积为X,则氢气的体积为8L-X.
2CO+O2
2CO2; 2H2+O2
2H2O.
2 1 2 2 1
X 0.5X X 8L-X 4L-0.5X
由题意可知,X+(12L-0.5X-4L+0.5X)=12L.
X=4L.
故填:4.
(2)解设一氧化碳的体积为X,则氢气的体积为8L-X.
由题意可知,X+(12L-0.5X-4L+0.5X)=VL.
X=(V-8)L,
则氢气的体积是:8L-(V-8)L=(16-V)L.
若剩余气体的体积是V L,则原混合气体中一氧化碳和氢气的体积比为:
.
(3)当一氧化碳的体积为接近8L时,剩余的气体体积最大;当氢气的体积为接近8L时,剩余的气体体积最小.
当一氧化碳的体积为8L时,剩余的气体体积为:8L+(12L-4L)=16L;
当氢气的体积为8L时,剩余的气体体积为:12L-4L=8L.
若剩余气体的体积为V L,则V的取值范围是8<V<16.
2CO+O2
| ||
| ||
2 1 2 2 1
X 0.5X X 8L-X 4L-0.5X
由题意可知,X+(12L-0.5X-4L+0.5X)=12L.
X=4L.
故填:4.
(2)解设一氧化碳的体积为X,则氢气的体积为8L-X.
由题意可知,X+(12L-0.5X-4L+0.5X)=VL.
X=(V-8)L,
则氢气的体积是:8L-(V-8)L=(16-V)L.
若剩余气体的体积是V L,则原混合气体中一氧化碳和氢气的体积比为:
| V-8 |
| 16-V |
(3)当一氧化碳的体积为接近8L时,剩余的气体体积最大;当氢气的体积为接近8L时,剩余的气体体积最小.
当一氧化碳的体积为8L时,剩余的气体体积为:8L+(12L-4L)=16L;
当氢气的体积为8L时,剩余的气体体积为:12L-4L=8L.
若剩余气体的体积为V L,则V的取值范围是8<V<16.
点评:解答本题要掌握根据化学方程式进行相关方面计算的方法,只有这样才能得出正确的结论.

练习册系列答案
相关题目
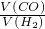 ═______;
═______; ═______;
═______;