题目内容
【题目】实验室有一瓶除去难溶性杂质的粗盐样品,其中还含有少量的氯化镁和氯化钙。为了得到较纯净的食盐晶体,同学们设计如下实验方案,请你参与他们的实验探究。
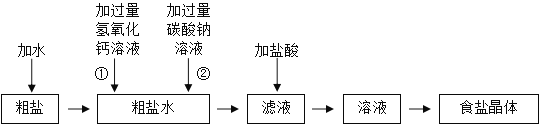
(1)实验过程中,向粗盐水中先加入过量的氢氧化钙溶液,再加入过量的碳酸钠溶液,依次加入的目的是_____,写出两种盐之间发生反应的化学方程式_____。
(2)实验过程中,用到的操作有_____,得到食盐晶体时,应在_____中进行。
【答案】除去![]() 、
、![]() 和过量的
和过量的![]()
![]() 溶解、过滤、蒸发 蒸发皿
溶解、过滤、蒸发 蒸发皿
【解析】
(1)由题意和流程图可知,粗盐样品中含有难溶性杂质、少量的氯化镁、氯化钙,加过量氢氧化钙溶液,氢氧化钙与氯化镁反应生成氢氧化镁沉淀和氯化钠,加过量氢氧化钙溶液的目的是除去氯化镁,再加入过量的碳酸钠溶液,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,除去氯化钙和过量的氢氧化钙,因此实验过程中,向粗盐水中先加入过量的氢氧化钙溶液,再加入过量的碳酸钠溶液,依次加入的目的是除去![]() 、
、![]() 和过量的
和过量的![]() 。氯化镁、氯化钙、碳酸钠属于盐,氢氧化钙属于碱,两种盐之间发生的反应为碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为
。氯化镁、氯化钙、碳酸钠属于盐,氢氧化钙属于碱,两种盐之间发生的反应为碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为![]() 。
。
(2)实验过程中用到的操作是先将粗盐样品溶解,加入试剂形成沉淀后过滤,滤液加入适量稀盐酸除去氢氧化钠、碳酸钠得到氯化钠溶液,最后蒸发结晶得到食盐晶体。得到食盐晶体的操作是蒸发,应在蒸发皿中进行。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】为了测定实验室中KClO3样品的纯度,某学习小组取2.5g该样品与0.5gMnO2混合,加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体的质量,重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体的质量,记录数据如下表所示。
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.48 | 2.34 | 2.04 | 2.04 |
请仔细分析实验数据,回答下列问题:
(1)在_____________时间后,该样品中的KClO3已经完全反应。
(2)完全反应后产生O2的质量是_______________。
(3)该样品中KClO3的质量是______。
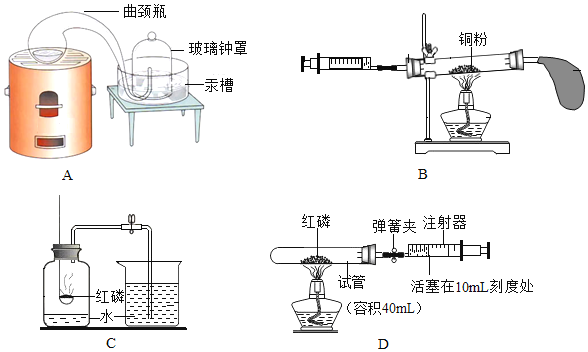
【题目】某兴趣小组根据下列装置进行实验,请你参与并回答:

(1)②仪器的名称是_____。
(2)若用A装置制取氧气,则①中可观察到的现象是_____(任答一点);写出该反应的化学方程式_____。
(3)B和C装置均可制取CO2,与B相比较,C的主要优点_____。
(4)常用金属锌和稀硫酸反应制取。若实验室要制取少量氢气最好选择发生装置_____(填字母);若用试管排空气法收集氢气,请在D处方框中画出装置图_____(只画试管和导气管)。
(5)某研究性学习小组为了测定某矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:(杂质不与稀盐酸反应)
实 验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
①表格中m的数值是_____。
②求石灰石中碳酸钙的质量分数_____。