题目内容
【题目】为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示。试计算:
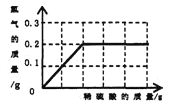
(1)样品中铜的质量分数;(3分)
(2)反应所消耗的硫酸溶液质量;(6分)
(3)反应后所得溶液中溶质的质量分数。(6分)(精确到百分之零点一)
【答案】(1)67.5%(2)100g(3)15.1%
【解析】
试题分析:根据图示看过程中共产生的氢气质量为0.2克,金属中只有锌能够和酸反应,所以设锌的质量为X,Zn+H2SO4ZnSO4+H2↑
65 2
X 0.2克
列比例式得65:X=2:0.2克求得X=6.5克,则铜的质量=20克-6.5克=13.5克,样品中铜的质量分数=13.5克/20克×100%=67.5%;设过程中反应所消耗的硫酸的质量为Y,同时产生的硫酸锌的质量为Z,
Zn+H2SO4ZnSO4+H2↑
98 161 2
Y Z 0.2克
列比例式得:98:Y=161:Z=2:0.2克解得Y=9.8克Z=16.1克,所以反应所消耗的硫酸溶液质量=9.8克/9.8%=100克,反应后所得溶液中溶质的质量分数=16.1克/(100克+6.5克-0.2克)×100%=15.1%

【题目】在对蜡烛及其燃烧的探究实验中,小明仔细观察蜡烛燃烧时的火焰,发现火焰中不同区域的明亮程度不同,这是为什么呢?在老师的指导下小明进行了以下探究活动。

【查阅资料】
(1)可燃物的种类及组成会影响火焰的明亮程度。
(2)蜡烛主要由石蜡制成,石蜡是石油炼制后得到的固体物质,主要由多种碳氢化合物组成,这些化合物分子中的碳原子数目不唯一,其化学式通式为CnH2n+2 ,通式中碳原子数n = 18~30。
(3)碳氢化合物在常温时的状态如下表所示。
物质名称 | 化学式 | 常温时的状态 |
丁烷 | C4H10 | 气 |
戊烷 | C5H12 | 液(油状) |
癸烷 | C10H22 | 液(油状) |
十八烷 | C18H38 | 固 |
二十四烷 | C24H50 | 固 |
(4)多数碳氢化合物在一定温度下会分裂为碳原子数较少的碳氢化合物或碳(黑色固体)和氢气。
【实验探究】
序号 | 实验目的 | 实验操作 | 实验现象 |
I | 探究哪一层火焰的温度最高 | 点燃蜡烛,把一根火柴梗平放在蜡烛的火焰中,约1s后取出观察 | |
Ⅱ | 探究焰心中参与燃烧的质的成分 | 点燃一根较粗的蜡烛,取一根一端为尖嘴的玻璃导管,一端伸入火焰的焰心处,然后在尖嘴一端导管口用火柴点燃 | 导管口处出现火焰 |
III | 继续探究焰心中参与燃烧的物质的成分 | 点燃一根蜡烛,用一把带有手柄的小刀,将刀尖伸入火焰中最暗的部分,即焰心处,一段时间后取出,冷却,观察刀尖处的现象 | 冷却至室温后,刀尖处有油状液体和固体物质 |
IV | 用镊子夹住一片白瓷片,将瓷片伸入火焰中最明亮的部分,即内焰处,观察现象 | 白瓷片表面迅速变黑 |
【分析和讨论】
(1)实验I中的实验现象为 。
(2)通过实验Ⅱ,你能分析出焰心处的物质具有的化学性质是 。
(3)实验III中,冷却后小刀表面的油状液体可能是 (填物质名称),生成油状液体的原因是 。
(4)实验IV的目的是 。
(5)分析实验IV中的现象,可推断出蜡烛火焰内焰处的物质中含有 (填物质名称),由此分析内焰处最明亮的原因是 。