题目内容
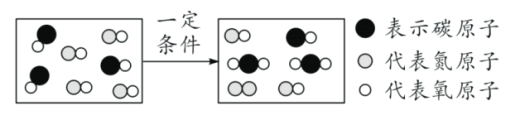
【题目】下图分别是水蒸气液化、水通电分解和氢气在氯气中燃烧的微观察变化示意图。


请回答下列问题:
(1)图②表示的化学方程式为_____。
(2)从微观角度解释图①、图②变化的本质区别是_____。
(3)由图②、图③可得到:化学变化中一定不变的是_____。
【答案】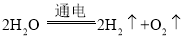 ①中水分子本身没有改变,只是分子间隔变小,发生了物理变化;②水分子变为氢分子和氧分子,发生了化学变化 原子
①中水分子本身没有改变,只是分子间隔变小,发生了物理变化;②水分子变为氢分子和氧分子,发生了化学变化 原子
【解析】
(1)通过分析可知,图②表示的是水在通电的条件下分解生成了氢气和氧气。故答案为: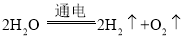 ;
;
(2)图①是水蒸气遇冷液化成水,是水分子之间的间隔变小,水分子自身没有发生变化,属于物理变化。电解水产生氢气和氧气,是水分子先破裂成氢原子和氧原子,然后每两个氢原子结合形成一个氢分子,每两个氧原子结合形成一个氧分子,水分子自身发生了变化,属于化学变化。故答案为:①中水分子本身没有改变,只是分子间隔变小,发生了物理变化;②水分子变为氢分子和氧分子,发生了化学变化;
(3)由图②、图③的微粒构成、变化可知,化学变化的微观实质是分子破裂成原子,原子再重新组合形成新的分子,因此化学变化中一定不变的微粒是原子。故答案为:原子。

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案【题目】某同学想在实验室里用NaOH溶液制取Na2CO3溶液。
查阅资料:①CO2通入NaOH溶液时极易因CO2过量而产生NaHCO3,且无明显现象
②NaHCO3溶液煮沸时不会发生分解
③![]()
④Ca(HCO3)2可溶于水
制取步骤:①量取两份50mL相同浓度的NaOH溶液备用;
②用一份50mLNaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③小心煮沸②溶液1~2分钟;
④_____,即得Na2CO3溶液。
实验探究:为了检验制得的溶液是否为纯净的Na2CO3溶液,请你与该同学一起完成下列实验探究:
实验步骤 | 实验现象 | 实验结论 | |
取少量制得的溶液于试管中,加入过量的_____溶液 | 产生白色沉淀 | 原来溶液含有Na2CO3 | |
将上步实验所得混合物进行过滤,将滤液分成两份 | 取其中一份加入足量的_____ | 无气泡产生 | 原来制得的溶液中不含_____ |
取另一份加入MgCl2溶液 | _____ | 原来制得的溶液中不含NaOH | |
结论:所制得的溶液为纯净的Na2CO3溶液
评价与反思:有人认为实验步骤③④的顺序对调,即先混合,再煮沸,更合理。你认为对吗?_____请说明理由:_____。