题目内容
碘酸钾(KIO3)主要用作食盐加碘剂
Ⅰ、制备碘酸钾
实验室制备碘酸钾的路线如下:

(1)KIO3中I的化合价为 ,含碘盐中的碘是指 (填字母)。
a、离子 b、元素 c、分子
(2)实验中需要用试纸测定溶液的PH,其操作方法是 。
(3)过滤操作需要的玻璃仪器有玻璃棒、烧杯和 。
(4)用冰水洗涤过滤所得KIO3晶体,其原因是 。
(5)温度过高,会造成H2O2利用率降低,可能的原因是 。
Ⅱ测定碘含量
资料:①碘酸钾与碘化钾反应方程式为:KIO3+5KI+3H2SO4===3K2SO4+3H2O+3I2
②淀粉溶液遇碘显色时,碘浓度越大颜色越深;
③扬州作为轻度缺碘地区,食盐中碘含量(以I计)应为18~33mg/Kg
步骤1:配置以下各种试剂:100g/L食盐溶液,2.14*10-3g/L KIO3溶液,测试液(含10g/L淀粉、196g/L H2SO4、1.66g/L KI)。
步骤2:取5支相同规格小试管,贴上编号标签,按下表要求分别依次加入步骤1中配置的KIO3溶液,测试液、蒸馏水,塞上橡皮塞,混合后有序放置在试管架上(各试管中KIO3完全反应)。
|
试管编号 |
1 |
2 |
3 |
4 |
5 |
|
KIO3溶液滴数 |
30 |
25 |
20 |
15 |
10 |
|
测试液滴数 |
10 |
10 |
10 |
10 |
10 |
|
蒸馏水滴数 |
0 |
5 |
10 |
15 |
20 |
步骤3:另取一支小试管,一次加入步骤1中所配置的食盐溶液10滴、测试液10滴、和蒸馏水20滴,混合后与步骤2中各试管内颜色对照。
(6)步骤3所得溶液呈 色,则说明该食盐是含碘盐。
(7)步骤2实验的目的是 ,步骤2中测试液的滴数保持一致的原因是 。
(8)若步骤3所得溶液颜色与3号试管一致,则100ml该食盐溶液中含有碘酸钾 mg。该食盐中碘含量为 mg/Kg, 扬州地区要求(填“符合”或“不符合”)。
I、(1)+5,b(2)用洁净的玻璃棒蘸取少量溶液,抹在试纸上,待试纸变色后与比色卡对照读取对应PH值(3)漏斗(4)KIO3在冰水中的溶解度很小,既可以除去晶体表面杂质,又可减少KIO3洗涤是的损失。(5)双氧水热稳定性差,温度较高时会分解产生水和氧气。
II、(6)蓝(7)得到不同浓度KIO3溶液的显色标准;控制测试液变量,保证加入各试管中的测试液的量相同(8)0.428,
【解析】由反应方程式知,碘酸钾与碘化钾的反应分子个数比是1:5,碘酸钾的分子量为214,碘化钾分子量为166,碘的分子量为254。知碘酸钾与碘化钾的质量之比为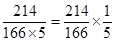 。碘酸钾溶液的浓度为2.14×10-3g/L,碘化钾的浓度为1.66g/L,根据步骤2中1号试管的滴加量来看,知30滴碘酸钾质量量为2.14×10-3g/L×30,10滴测试液中碘化钾的质量为1.66g/L×10,质量之比是
。碘酸钾溶液的浓度为2.14×10-3g/L,碘化钾的浓度为1.66g/L,根据步骤2中1号试管的滴加量来看,知30滴碘酸钾质量量为2.14×10-3g/L×30,10滴测试液中碘化钾的质量为1.66g/L×10,质量之比是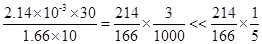 ,所以在实验中碘化钾是过量的,碘酸钾充分反应。
,所以在实验中碘化钾是过量的,碘酸钾充分反应。
步骤3所测溶液颜色与步骤2中3号试管颜色一致,说明两个实验产生的碘的浓度是相同的,因为都是40滴溶液的体积,所以浓度时相同的。
设3号试管中产生的碘的浓度为x g/L,步骤3中所测食盐溶液中碘酸钾的浓度为y g/L。
首先对步骤2中3号试管的反应进行分析:
列反应方程式: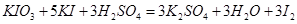
214 254×3
2.14×10-3g/L×20 x g/L ×40
得方程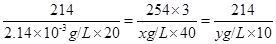 --------------①;
--------------①;
再对步骤3实验进行分析:加食盐溶液10滴,产生碘的浓度也为x g/L。
方程式相同,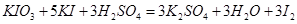
214 254×3
y g/L×10 x g/L ×40
得方程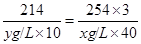 ------------------②。
------------------②。
① ②联立,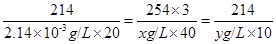
得,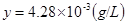
所以100ml食盐溶液中含碘酸钾的量为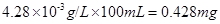 。
。
因食盐溶液浓度为100g/L,所以食盐溶液中碘的含量为,
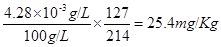 ,18mg/Kg<25.4mg/Kg<33mg/Kg,符合扬州标准。
,18mg/Kg<25.4mg/Kg<33mg/Kg,符合扬州标准。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案