题目内容
【题目】小刘同学想在实验室里用NaOH溶液制取Na2CO3溶液口
【查阅资料】①CO2通入NaOH溶液时极易因CO2过量而产生NaHCO3,且无明显现象.

【制取步骤】①量取两份50 mL相同浓度的NaOH溶液备用;
②用一份50 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③小心煮沸②溶液1-2分钟;
④在得到的③的溶液中加入另一份50 mL NaOH溶液,使其充分混合即得.
【实验探究】为了检验制得的溶液是否为纯净的Na2CC3溶液,请你与小刘同学一起完成下列实验探究:
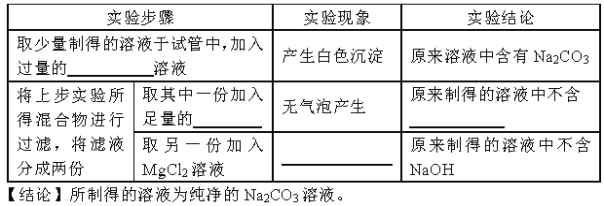
【评价与反思】有人认为实验步骤③④的顺序对调,即先混合,再煮沸,更合理口你认为对吗? 请说明理由:
【答案】CaCl2 稀HCl NaHCO3 无明显现象 不对,如果对调,不能除去水中的二氧化碳,使碳酸氢钠不能全部转化为碳酸钠
【解析】
试题分析:检验是否含有碳酸钠实际是检验是否含有碳酸根离子,那么可加入氯化钙溶于,若含有碳酸钠,那么碳酸钠会与氯化钙反应生成碳酸钙沉淀;由于通入的二氧化碳过量时会产生碳酸氢钠,故溶液中若含有碳酸氢钠,过滤后,那么加入稀盐酸会产生大量的气泡;若溶液中含有氢氧化钠,那么氯化镁和氢氧化钠反应生成氢氧化镁沉淀,若没有氢氧化钠则不会生成沉淀;步骤三煮沸的目的是除去水中的二氧化碳,若对调,不能除去水中的二氧化碳,使碳酸氢钠不能全部转化为碳酸钠。

 考前必练系列答案
考前必练系列答案【题目】育才中学的某研究小组在探究维生素C水溶液的酸碱性时,不慎误把维C泡腾片(保健品。主要成分如图所示)当做维生素C片放入了水中,结果发现有大量气泡产生,于是引起了该小组同学的探究性趣。

【提出问题】该气体成分是什么?
【猜想与假设】小青说:该气体可能含有CO2、O2、CO、H2、N2中的一种或几种。小丽说:不可能含有N2,因为
小亮说:不可能含有H2 和CO,因为从药品安全角度考虑,H2易燃易爆,CO 最后研究小组的同学共同认为:该气体可能含有CO2 、O2中的一种或两种。
编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清的石灰水 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入到该气体中 | 带火星的木条没有复燃 |
【进行实验】
编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清的石灰水 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入到该气体中 | 带火星的木条没有复燃 |
【得出结论】(1)由实验①可知,该气体中肯定含有 ,写出该反应的化学方程式 ;(2)由实验② (填“能”或“不能”)确定该气体中不含氧气,理由是 。
