题目内容
(2011?杨浦区二模)请参与某化学学习小组进行研究性学习的过程,并协助完成相关任务:
(1)为了验证铜、银、镁、铁的金属活动性顺序,小明同学设计如下实验方案:
a.将金属镁和铁分别放入到稀酸溶液中;b.将铜片放入到硝酸银溶液中.
①在步骤a中,所控制的实验条件是
②小红同学认为,小明同学的实验方案不足以说明铜、银、镁、铁的金属活动性顺序,还需要进行一个实验,该实验的实验步骤是
(2)小王同学选择“镁丝和硫酸反应的快慢与什么因素有关”的课题开展探究.下表是他分别用相同质量的镁丝和足量稀硫酸反应的三组实验数据:
①实验②和③表明:该反应快慢与
②能表明硫酸浓度对反应快慢有影响的实验编号是:
③如果实验①中硫酸的质量分数改为4%,请推出镁丝消失的时间(用t表示)的取值范围
④该实验除了用镁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量反应的快慢吗?方法
(1)为了验证铜、银、镁、铁的金属活动性顺序,小明同学设计如下实验方案:
a.将金属镁和铁分别放入到稀酸溶液中;b.将铜片放入到硝酸银溶液中.
①在步骤a中,所控制的实验条件是
金属的形状和酸的种类、浓度
金属的形状和酸的种类、浓度
.②小红同学认为,小明同学的实验方案不足以说明铜、银、镁、铁的金属活动性顺序,还需要进行一个实验,该实验的实验步骤是
铜放入稀酸中
铜放入稀酸中
.(2)小王同学选择“镁丝和硫酸反应的快慢与什么因素有关”的课题开展探究.下表是他分别用相同质量的镁丝和足量稀硫酸反应的三组实验数据:
| 实验编号 | 硫酸的质量分数/% | 反应的温度 | 镁丝消失的时间/s |
| ① | 3 | 20 | 500 |
| ② | 6 | 20 | 300 |
| ③ | 6 | 30 | 80 |
温度
温度
有关.②能表明硫酸浓度对反应快慢有影响的实验编号是:
①
①
和②
②
.③如果实验①中硫酸的质量分数改为4%,请推出镁丝消失的时间(用t表示)的取值范围
300<t<500
300<t<500
.④该实验除了用镁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量反应的快慢吗?方法
收集等量氢气所需时间
收集等量氢气所需时间
.分析:(1)根据变量唯一的原则解答.排在氢前的金属能与酸反应,排在氢后的金属不能与酸反应
(2)根据对比实验的表格,变量唯一,通过变量看镁丝消失的时间
(2)根据对比实验的表格,变量唯一,通过变量看镁丝消失的时间
解答:解:(1)①要验证铜、银、镁、铁的金属活动性顺序,必须控制变量唯一,变量是金属的种类,而其它的量金属的形状和酸的种类、浓度 必须相同.
②将金属镁和铁分别放入到稀酸溶液中,镁和铁都能与酸反应产生氢气,而镁反应剧烈,根据反应的剧烈程度可以确定出镁和铁的活动性顺序;b.将铜片放入到硝酸银溶液中,铜能将银置换出来,说明铜的活动性比银强,但铜与铁的活动性没法比较,故应增加的步骤是铜放入稀酸中
(2)①实验②和③中温度不同,镁丝消失的时间不同,说明该反应快慢与温度有关.
②实验①和②中硫酸浓度不同,镁丝消失时间不同,说明反应快慢与硫酸浓度有关.
③根据表格中数据,硫酸浓度为3%时,镁丝消失的时间为500,硫酸浓度为6%时,消失时间为300,所以如果实验①中硫酸的质量分数改为4%,镁丝消失的时间(用t表示)的取值范围 300<t<500.
④该实验除了用镁丝消失的时间来衡量反应的快慢外,还可以通过收集等量氢气所需时间来衡量反应的快慢.
答:(1)金属的形状和酸的种类、浓度 铜放入稀酸中
(2)温度 ①②300<t<500 收集等量氢气所需时间
②将金属镁和铁分别放入到稀酸溶液中,镁和铁都能与酸反应产生氢气,而镁反应剧烈,根据反应的剧烈程度可以确定出镁和铁的活动性顺序;b.将铜片放入到硝酸银溶液中,铜能将银置换出来,说明铜的活动性比银强,但铜与铁的活动性没法比较,故应增加的步骤是铜放入稀酸中
(2)①实验②和③中温度不同,镁丝消失的时间不同,说明该反应快慢与温度有关.
②实验①和②中硫酸浓度不同,镁丝消失时间不同,说明反应快慢与硫酸浓度有关.
③根据表格中数据,硫酸浓度为3%时,镁丝消失的时间为500,硫酸浓度为6%时,消失时间为300,所以如果实验①中硫酸的质量分数改为4%,镁丝消失的时间(用t表示)的取值范围 300<t<500.
④该实验除了用镁丝消失的时间来衡量反应的快慢外,还可以通过收集等量氢气所需时间来衡量反应的快慢.
答:(1)金属的形状和酸的种类、浓度 铜放入稀酸中
(2)温度 ①②300<t<500 收集等量氢气所需时间
点评:验证金属活动性顺序的方法可用金属与酸反应,也可能用金属与盐溶液反应来判断.

练习册系列答案
相关题目
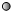 ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,则如图所示的化学反应方程式为:
”表示氧原子,则如图所示的化学反应方程式为: