题目内容
【题目】某研究性学习小组对中和反应进行探究,请你参与实验。
(实验一)证明酸和碱发生了反应。
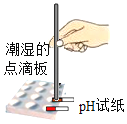
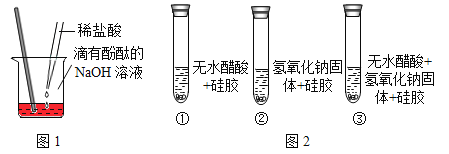
稀盐酸和NaOH溶液混合没有明显现象,小李同学按如图1所示,首先向盛有适量NaOH溶液的试管中滴加了2~3滴酚酞溶液,接着向试管中逐滴加入稀盐酸,当观察到______的现象时,证明了盐酸和NaOH溶液发生化学反应。
(实验二)证明酸碱反应有水生成。
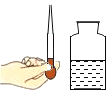
小杨取变色硅胶(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢 氧化钠固体进行如图2所示的三个实验。
(1)实验①、②的实验目的是________;
(2)能证明酸和碱反应有水生成的现象是_______。
(实验三)探究酸和碱反应过程中溶液pH、温度的变化。
小芳和小敏同学在老师指导下,取一定量的氢氧化钠,逐滴匀速滴加稀盐酸溶液,用电子传感器实时获得溶液的pH、温度曲线如图3、如图4。
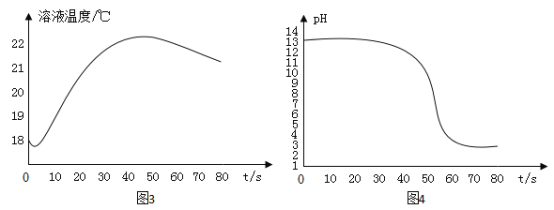
(1)由图4分析,酸和碱发生反应的依据是_______其反应方程式为:_______。
(2)由图3分析,酸和碱的反应是________反应(填“吸热”或“放热”)。
(3)在小亮的实验中,当实验进行到60秒时,溶液中含有的溶质是______(填化学式),该溶液能与下列物质发生反应的是_______(填序号).
①碳酸钠 ②氧化铜 ③硫酸铜 ④镁
(4)微粒观是化学基本观念的重要组成部分,也是化学基本观念中最基础的部分,从微观视角认识和考察物质世界是研究化学应掌握的重要思维方法,试从微观角度分析酸碱中和反应的实质是__________。由中和反应实质可以知道部分离子在水溶液中不能共存,请再写出一组不能共存的离子______。
【答案】溶液由红色变为无色 硅胶、无水醋酸都不含有水 变色硅胶由蓝色变成了红色 溶液的pH减小,减小至7 NaOH+HCl=NaCl+H2O 放热 HCl、NaCl ①②④ 氢离子和氢氧根离子结合生成水分子 Ca2+、CO32-(合理即可)
【解析】
[实验一]氢氧化钠溶液加入酚酞显红色,加入稀盐酸生成了氯化钠和水,当观察到溶液由红色变为无色,证明了盐酸和NaOH溶液发生化学反应,故填:溶液由红色变为无色。
[实验二]
(1)实验①、②的实验目的是说明了硅胶、无水醋酸都不含有水;
(2)由于氢氧化钠和醋酸发生中和反应生成了水,水能使硅胶由蓝色变成了红色,所以能证明酸和碱反应有水生成的现象是:变色硅胶由蓝色变成了红色。
[实验三]
(1)由图4可知,酸和碱发生反应的依据是溶液的pH减小,减小至7,氢氧化钠与稀盐酸反应生成了氯化钠和水,其反应方程式为:NaOH+HCl=NaCl+H2O,故填:溶液的pH减小;NaOH+HCl=NaCl+H2O。
(2)由图3可知溶液的温度升高,说明了酸和碱的反应是放热反应,故填:放热。
(3)在小亮的实验中,当实验进行到60秒时溶液pH小于7,盐酸过量,溶液中含有的溶质是NaCl和HCl,该溶液含有盐酸,盐酸能与碳酸钠、氧化铜、镁反应,分别生成氯化钠二氧化碳和水,氯化铜和水,氯化镁和氢气,故填:HCl、NaCl;①②④。
(4)酸碱中和反应的实质是氢离子和氢氧根离子结合生成水分子,由中和反应实质可以知道部分离子在水溶液中不能共存,比如钙离子和碳酸根离子生成碳酸钙沉淀,故填:氢离子和氢氧根离子结合生成水分子;Ca2+、CO32-。

【题目】由于![]() 能作
能作![]() 溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧化物是否也可以作
溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧化物是否也可以作![]() 溶液分解的催化剂?请你参与他们的探究过程.
溶液分解的催化剂?请你参与他们的探究过程.
(1)[猜想]:![]() 能作过氧化氢分解的催化剂.
能作过氧化氢分解的催化剂.
(2)[实验验证]:
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | ________ |
实验二 | ________ | 木条复燃 |
|
(3)[结论]:故![]() 能作
能作![]() 溶液分解的催化剂.
溶液分解的催化剂.
(4)[讨论与思考]:有的同学认为只有上述两个实验,不能完全证明![]() 在
在![]() 溶液分解中起了催化作用.还应补充一个上述反应前后
溶液分解中起了催化作用.还应补充一个上述反应前后![]() 质量是否改变的探究实验.
质量是否改变的探究实验.
实验三:①准确称量![]() (少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行:________;④________.
(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行:________;④________.
(5)有同学认为,即使实验三中![]() 在反应前后质量不变,要证明猜想.上述三个实验还不足够,仍需要再探究
在反应前后质量不变,要证明猜想.上述三个实验还不足够,仍需要再探究![]() 的________.
的________.