题目内容
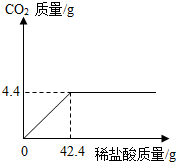 某班一次社会实践活动是到碱厂参观,该厂主要产品之一是纯碱.参观结束,同学们带回一些化验室里废弃的纯碱样品,来测定其中碳酸钠的质量分数(假设该样品中只含有氯化钠一种杂质).取样品12g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
某班一次社会实践活动是到碱厂参观,该厂主要产品之一是纯碱.参观结束,同学们带回一些化验室里废弃的纯碱样品,来测定其中碳酸钠的质量分数(假设该样品中只含有氯化钠一种杂质).取样品12g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)(1)样品中氯化钠的质量.
(2)所用的稀盐酸溶质质量分数.
(3)恰好完全反应时,所得溶液中溶质的质量分数.
分析:碳酸钠与盐酸反应,生成氯化钠、水和二氧化碳;根据质量关系图,当加入42.4g稀盐酸时恰好完全反应,放出气体二氧化碳的质量为4.4g;
(1)根据化学方程式,由产生二氧化碳气体的质量计算样品中碳酸钠的质量,样品质量减去碳酸钠的质量既得氯化钠的质量;
(2)根据化学方程式,由产生二氧化碳气体的质量计算42.4g稀盐酸中所含氯化氢的质量,进一步可求得稀盐酸溶质质量分数
(3)恰好完全反应,所得溶液为氯化钠溶液,溶质的质量为生成的氯化钠的质量与样品中杂质氯化钠的质量之和;
(1)根据化学方程式,由产生二氧化碳气体的质量计算样品中碳酸钠的质量,样品质量减去碳酸钠的质量既得氯化钠的质量;
(2)根据化学方程式,由产生二氧化碳气体的质量计算42.4g稀盐酸中所含氯化氢的质量,进一步可求得稀盐酸溶质质量分数
(3)恰好完全反应,所得溶液为氯化钠溶液,溶质的质量为生成的氯化钠的质量与样品中杂质氯化钠的质量之和;
解答:解:设样品中碳酸钠的质量为x,稀盐酸中所含氯化氢的质量为y,生成氯化钠的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y z 4.4g
=
=
=
x═10.6g y=7.3g z=11.7g
(1)样品中氯化钠的质量为:12g-10.6g=1.4g
(2)稀盐酸溶液中溶质的质量分数为:
×100%=17.2%
(3)反应后所得溶液中溶质的质量分数为:
×100%=26.2%
答:样品中氯化钠的质量为1.4克;
稀盐酸溶液中溶质的质量分数为17.2%;
反应后所得溶液中溶质的质量分数为26.2%
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y z 4.4g
| 106 |
| x |
| 73 |
| y |
| 117 |
| z |
| 44 |
| 4.4g |
x═10.6g y=7.3g z=11.7g
(1)样品中氯化钠的质量为:12g-10.6g=1.4g
(2)稀盐酸溶液中溶质的质量分数为:
| 7.3g |
| 42.4g |
(3)反应后所得溶液中溶质的质量分数为:
| 11.7g+1.4g |
| 42.4g+12g-4.4g |
答:样品中氯化钠的质量为1.4克;
稀盐酸溶液中溶质的质量分数为17.2%;
反应后所得溶液中溶质的质量分数为26.2%
点评:反应与图象结合类问题,根据图形分析反应的进程是进行答题的基础,图象出现的拐点为恰好完全反应点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
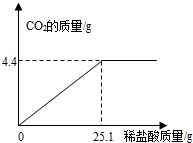 某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠).参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.3g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠).参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.3g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)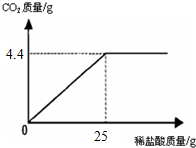 某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打.参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中小苏打的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.4g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(计算结果保留到小数点后一位数字)
某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打.参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中小苏打的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.4g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(计算结果保留到小数点后一位数字)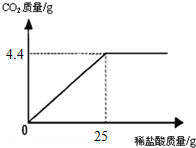 某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打.参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中小苏打的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.4g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(计算结果保留到小数点后一位数字)
某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打.参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中小苏打的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.4g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(计算结果保留到小数点后一位数字)