题目内容
实验室用石灰石(杂质既不溶于水也不与稀盐酸反应)和稀盐酸反应制取二氧化碳.
(1)实验结束后,锥形瓶内已无气泡产生,但还有少量固体剩余.
甲同学和乙同学对锥形瓶内溶液中溶质的成分展开辩论:甲说:因为瓶内有固体剩余,所以溶液中只有氯化钙(氯化钙溶液呈中性)而无盐酸.乙不完全同意甲的说法,请你说出乙的理由________.
按乙的猜想,写出溶液中溶质成分的几种可能________(用化学式表示),请你选择其中一种情况,设计实验证明,完成下列探究报告:
| 猜想 | 实验步骤 | 实验现象及结论 |
| ________ | ________ | ________ |
第一步:称取烧杯的质量为50.0g;
第二步:将适量盐酸加入烧杯中并称重,烧杯和盐酸的总质量为100.0g;
第三步:称取少量石灰石样品(质量为12.0g)加入烧杯中,使之与过量稀盐酸反应;
第四步:待反应完全后,称重,烧杯和其中混合物的总质量为107.6g.
试通过分析计算:
①该实验中生成的二氧化碳的物质的量是多少?
②该石灰石样品中碳酸钙的质量分数是多少?(根据化学方程式列式计算,结果精确到0.1%)
解:(1)甲说,因为瓶内有固体剩余,所以溶液中只有氯化钙而无盐酸.乙不完全同意甲的说法,乙的理由是剩余固体可能完全是杂质;碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,因此溶液中一定有氯化钙,盐酸可能有,也可能没有,因此可能有两种情况,CaCl2和HCl或CaCl2;我验证猜想是氯化钙和盐酸,取少量溶液于试管中,滴加石蕊试液;紫色石蕊试液变红,有盐酸和氯化钙;故答案为:剩余固体可能完全是杂质;CaCl2和HCl或CaCl2
猜想:氯化钙和盐酸; 取少量溶液于试管中,滴加石蕊试液;紫色石蕊试液变红,有盐酸和氯化钙;
(2)根据质量守恒定律,二氧化碳的质量=100.0g+12.0g-107.6g=4.4g,二氧化碳的物质的量=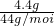 =0.1mol,故答案为:0.1mol
=0.1mol,故答案为:0.1mol
解:设该石灰石中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
1mol 1mol
x 0.1mol
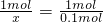 x=0.1mol
x=0.1mol
所以:该石灰石中碳酸钙的质量分数=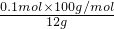 ×100%=83.3%
×100%=83.3%
答:该石灰石中碳酸钙的质量分数为83.3%.
故答案为:83.3%
分析:根据题目给出的信息:甲说,因为瓶内有固体剩余,所以溶液中只有氯化钙而无盐酸.乙不完全同意甲的说法,乙的理由是剩余固体可能完全是杂质;碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,因此溶液中一定有氯化钙,盐酸可能有,也可能没有;根据质量守恒定律求二氧化碳的质量,根据化学方程式的计算求碳酸钙的质量分数.
点评:本考点考查了实验步骤的设计和有关化学方程式的计算等,有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;本考点主要出现在实验题和计算题中.
猜想:氯化钙和盐酸; 取少量溶液于试管中,滴加石蕊试液;紫色石蕊试液变红,有盐酸和氯化钙;
(2)根据质量守恒定律,二氧化碳的质量=100.0g+12.0g-107.6g=4.4g,二氧化碳的物质的量=
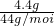 =0.1mol,故答案为:0.1mol
=0.1mol,故答案为:0.1mol解:设该石灰石中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
1mol 1mol
x 0.1mol
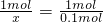 x=0.1mol
x=0.1mol 所以:该石灰石中碳酸钙的质量分数=
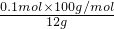 ×100%=83.3%
×100%=83.3%答:该石灰石中碳酸钙的质量分数为83.3%.
故答案为:83.3%
分析:根据题目给出的信息:甲说,因为瓶内有固体剩余,所以溶液中只有氯化钙而无盐酸.乙不完全同意甲的说法,乙的理由是剩余固体可能完全是杂质;碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,因此溶液中一定有氯化钙,盐酸可能有,也可能没有;根据质量守恒定律求二氧化碳的质量,根据化学方程式的计算求碳酸钙的质量分数.
点评:本考点考查了实验步骤的设计和有关化学方程式的计算等,有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;本考点主要出现在实验题和计算题中.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目