题目内容
【题目】某化学兴趣小组用图所示的实验装置,探究影响过氧化氢分解速率的因素。
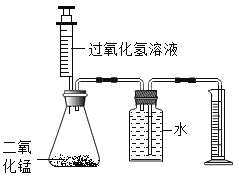
(1)装置中使用注射器的优点是___________________ , 锥形瓶中反应的化学方程式为__________________ 。
(2)下面是用上述装置实验时,收集的相关数据:
实验序号 | H2O2溶液浓度% | 体积ml | MnO2的量/g | 温度/°C | 待测数据 | 反应所需的时间/s |
① | 5 | 2 | 0.1 | 20 | 18 | |
② | 10 | 2 | 0.1 | 20 | 6 | |
③ | 5 | 2 | / | 20 | 64 | |
④ | 5 | 2 | / | 60 | 25 |
(3)从实验①和②对比可知,化学反应速率与__________________有关;从实验__________________对比可知,化学反应速率与是否加MnO2有关。表格中的待测数据那一栏应该是___________________ 。
(4)发现问题:实验温度最难控制,反应一段时间后溶液的温度总是比起始温度高,说明反应__________________ (填“放出”或“吸收”)热量
(5)继续探究:除了该实验小组探究过的因素以外,你若还有其他影响反应速率的因素及探究方法,请写在下面_________________ 。
【答案】可控制反应的速率 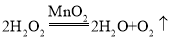 过氧化氢溶液浓度 ①③ 收集氧气的体积 放出 催化剂的颗粒大小;20℃时,分别取2mL5%过氧化氢溶液于两支试管中,一支试管中加入0.1g颗粒大的二氧化锰,另一支试管中加入0.1g颗粒小的二氧化锰,分别收集相同体积的氧气,记录反应所需时间。(另外还有催化剂种类等因素也可能影响反应速率,答案合理即可)
过氧化氢溶液浓度 ①③ 收集氧气的体积 放出 催化剂的颗粒大小;20℃时,分别取2mL5%过氧化氢溶液于两支试管中,一支试管中加入0.1g颗粒大的二氧化锰,另一支试管中加入0.1g颗粒小的二氧化锰,分别收集相同体积的氧气,记录反应所需时间。(另外还有催化剂种类等因素也可能影响反应速率,答案合理即可)
【解析】
结合实验装置图可知:
(1)装置中使用注射器的优点是可以通过控制加入的过氧化氢溶液的量来控制反应的速率, 锥形瓶中反应的化学方程式为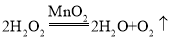 。
。
(2)表格中的数据以过氧化氢溶液浓度、温度、有无二氧化锰来进行探究,结合收集的相关数据可知:
(3)从实验①和②对比可知,化学反应速率与过氧化氢溶液浓度有关;从实验①③对比可知,化学反应速率与是否加MnO2有关。表格中的待测数据那一栏应该是收集氧气的体积。
(4)发现问题:实验温度最难控制,反应一段时间后溶液的温度总是比起始温度高,说明反应放出热量
(5)继续探究:除了该实验小组探究过的因素以外,催化剂的颗粒大小也可能是影响反应速率的因素,探究如下:
20℃时,分别取2mL5%过氧化氢溶液于两支试管中,一支试管中加入0.1g颗粒大的二氧化锰,另一支试管中加入0.1g颗粒小的二氧化锰,分别收集相同体积的氧气,记录反应所需时间。(另外还有催化剂种类等因素也可能影响反应速率,答案合理即可)

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】垃圾是放错地方的资源,垃圾分类是对垃圾进行有效处理的一种科学方法。
(1)垃圾分类是把各种垃圾收集后,进行分类处理,对其中燃烧值较高的进行高温焚烧发电,垃圾焚烧发电是将_____能转化为电能。
(2)喝完饮料后的易拉罐属于_____(填序号)。
不可回收物 |
厨余垃圾 |
有害垃圾 |
可回收物 |
A | B | C | D |
(3)请你说出一点垃圾分类处理的好处:_____。