题目内容
如何合理、高效、节约地使用煤、石油、天然气这三大当今世界最主要的化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.回答下列问题:(1)天然气已逐渐成为部分城市家庭的主要生活燃料.为防止因天然气泄漏造成危险,可在家中安装报警器,在甲、乙两图中,安装位置正确的是 ;(填“甲”或“乙”)
(2)煤燃烧时产生的 是形成酸雨的主要气体之一,因此,煤的气化是把煤变为清洁能源的重要一环,其中一个重要反应是:C+H2O
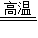 CO+H2,该反应的基本类型是 .
CO+H2,该反应的基本类型是 .(3)煤不仅可以作燃料,还可以用于制取乙二醇.如图是制取乙二醇的流程示意图为:煤
 (
(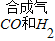 )→乙二醇;
)→乙二醇;①合成气具有还原性,写出CO还原氧化铜的化学方程式: .
②乙二醇与乙醇化学性质相似,推测乙二醇的一个化学性质: .
③若仅以合成气(CO和H2)为原料不可能得到的物质是 (填字母序号).
a.草酸(HOOCCOOH);b.甲醇(CH3OH);c.尿素[CO(NH2)2]
(4)汽车尾气系统中使用催化转化器,可降低CO、NO等有毒气体的排放,其反应化学方程式为:2CO+2NO
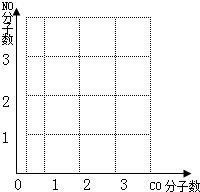
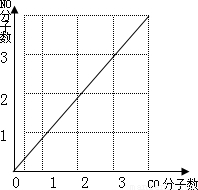
 2CO2+N2,当有5.6gCO被转化时,计算:①同时被转化的NO的质量.(需写出计算过程) ②图坐标中横坐标为CO为分子数,纵坐标为NO分子数,请你在图中绘制出上述反应中CO、NO变化图象. (请在答卷纸上完成绘图)
2CO2+N2,当有5.6gCO被转化时,计算:①同时被转化的NO的质量.(需写出计算过程) ②图坐标中横坐标为CO为分子数,纵坐标为NO分子数,请你在图中绘制出上述反应中CO、NO变化图象. (请在答卷纸上完成绘图)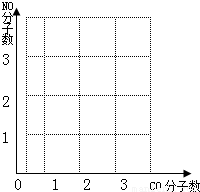

【答案】分析:(1)天然气的密度比空气小,报警器应该安置在高处.
(2)二氧化硫是形成酸雨的一种重要物质,根据化学方程式可以判断反应类型;
(3)氧化铜和一氧化碳在加热的条件下生成铜和二氧化碳.乙醇具有可燃性,可以推测乙二醇也具有可燃性.化学变化遵循质量守恒定律.
(4)欲计算同时被转化的NO的质量,需根据化学方程式得出各物质之间的质量比,写出比例式,就可求出被转化的NO的质量.
解答:解:(1)因为天然气的密度比空气小,所以警报器应该安置在高处.故填:甲.
(2)煤燃烧时产生的二氧化硫是形成酸雨的主要气体之一.故填:二氧化硫.
由C+H2O CO+H2可知,反应物和生成物都是一种单质和一种化合物,属于置换反应.故填:置换反应.
CO+H2可知,反应物和生成物都是一种单质和一种化合物,属于置换反应.故填:置换反应.
(3)①氧化铜和一氧化碳在加热的条件下生成铜和二氧化碳,反应的化学方程式为:CO+CuO Cu+CO2.
Cu+CO2.
②醇类物质具有相似的化学性质,因为乙醇具有可燃性,可以判断出乙二醇具有可燃性.故填:具有可燃性.
③因为反应物中含有碳元素、氢元素和氧元素,根据质量守恒定律可知,生成物中也应该含有碳元素、氢元素和氧元素,生成物不可能是尿素.故填:c.
(4)解:设被转化的NO的质量为x
2CO+2NO 2CO2+N2
2CO2+N2
56 60
5.6g x
∴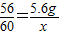
解之得:x=6g
答:同时被转化的NO的质量为6g.
根据化学反应式可知,一氧化碳和一氧化氮的分子个数比是1:1,所以CO、NO变化图象如下图:
点评:本题考查天然气的密度、酸雨的形成、化学反应的类型、根据信息与相关知识对问题做合理的推测,以及化学反应式的有关计算,考查内容的,难度较大,同学们一定要细心考虑.
(2)二氧化硫是形成酸雨的一种重要物质,根据化学方程式可以判断反应类型;
(3)氧化铜和一氧化碳在加热的条件下生成铜和二氧化碳.乙醇具有可燃性,可以推测乙二醇也具有可燃性.化学变化遵循质量守恒定律.
(4)欲计算同时被转化的NO的质量,需根据化学方程式得出各物质之间的质量比,写出比例式,就可求出被转化的NO的质量.
解答:解:(1)因为天然气的密度比空气小,所以警报器应该安置在高处.故填:甲.
(2)煤燃烧时产生的二氧化硫是形成酸雨的主要气体之一.故填:二氧化硫.
由C+H2O
 CO+H2可知,反应物和生成物都是一种单质和一种化合物,属于置换反应.故填:置换反应.
CO+H2可知,反应物和生成物都是一种单质和一种化合物,属于置换反应.故填:置换反应.(3)①氧化铜和一氧化碳在加热的条件下生成铜和二氧化碳,反应的化学方程式为:CO+CuO
 Cu+CO2.
Cu+CO2.②醇类物质具有相似的化学性质,因为乙醇具有可燃性,可以判断出乙二醇具有可燃性.故填:具有可燃性.
③因为反应物中含有碳元素、氢元素和氧元素,根据质量守恒定律可知,生成物中也应该含有碳元素、氢元素和氧元素,生成物不可能是尿素.故填:c.
(4)解:设被转化的NO的质量为x
2CO+2NO
 2CO2+N2
2CO2+N256 60
5.6g x
∴
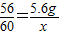
解之得:x=6g
答:同时被转化的NO的质量为6g.
根据化学反应式可知,一氧化碳和一氧化氮的分子个数比是1:1,所以CO、NO变化图象如下图:

点评:本题考查天然气的密度、酸雨的形成、化学反应的类型、根据信息与相关知识对问题做合理的推测,以及化学反应式的有关计算,考查内容的,难度较大,同学们一定要细心考虑.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 如何合理、高效、节约地使用煤、石油、天然气这三大化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.请按要求回答下列问题.
如何合理、高效、节约地使用煤、石油、天然气这三大化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.请按要求回答下列问题.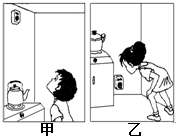 如何合理、高效、节约地使用煤、石油、天然气这三大当今世界最主要的化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.回答下列问题:
如何合理、高效、节约地使用煤、石油、天然气这三大当今世界最主要的化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.回答下列问题: