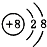题目内容
 (2009?海淀区二模)某工厂废液中含有氯化钠、氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),实验方案如下图所示.用到的相关信息如右图.
(2009?海淀区二模)某工厂废液中含有氯化钠、氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),实验方案如下图所示.用到的相关信息如右图.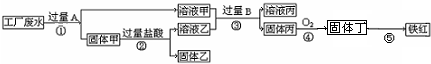
(1)推断物质.B为
NaOH
NaOH
;固体甲成分为铜和铁的混合物
铜和铁的混合物
(2)工厂废液中加入过量A的化学方程式为
Fe+CuCl2═Cu+FeCl2
Fe+CuCl2═Cu+FeCl2
.(3)步骤③发生反应的化学方程式为
2NaOH+FeCl2=═Fe(OH)2↓+2NaCl
2NaOH+FeCl2=═Fe(OH)2↓+2NaCl
.(4)检验A是否过量的方法为
步骤②中是否产生气泡,如果产生气泡则说明A过量
步骤②中是否产生气泡,如果产生气泡则说明A过量
.(5)步骤⑤发生反应的化学方程式为
2Fe(OH)3
Fe2O3+3H2O
| ||
2Fe(OH)3
Fe2O3+3H2O
.
| ||
分析:根据题意结合图中信息可以知道加入过量A后得到了固体甲和溶液甲,然后向固体甲中加入了过量盐酸仍有固体存在,结合题给的三种物质可以知道固体乙为铜,而加入A为铁,所以溶液乙为氯化亚铁溶液,而溶液甲为氯化钠和氯化亚铁的混合溶液,根据题给的资料可以知道固体丁应该为氢氧化铁,而固体丙为请氧化亚铁,所以可以判断加入的B为氢氧化钠溶液或是其他可溶性的碱,至此图中信息分析完毕,可以据此结合相关物质的性质来完成解答.
解答:解:(1)根据题意结合图中信息可以知道加入过量A后得到了固体甲,和溶液甲,然后向固体甲中加入了过量盐酸仍有固体存在,结合题给的三种物质可以知道固体乙为铜,而加入A为铁,所以溶液乙为氯化亚铁溶液,而溶液甲为氯化钠和氯化亚铁的混合溶液,根据题给的资料可以知道固体丁应该为氢氧化铁,而固体丙为请氧化亚铁,所以可以判断加入的B为氢氧化钠溶液或是其他可溶性的碱;
(2)根据(1)的分析可以知道加入过量A后所发生的反应为铁和氯化铜的反应,其化学方程式为:Fe+CuCl2═Cu+FeCl2;
(3)根可以知道步骤3中发生的反应为氢氧化钠和氯化亚铁的反应,即为:2NaOH+FeCl2=═Fe(OH)2↓+2NaCl;
(4)根据铁的性质可以知道,铁可以和稀盐酸反应生成气体,所以可以向固体甲中加入盐酸,如果铁过量,则会产生气体;
(5)根据铁给的信息可以知道氢氧化铁可以在加热的条件下反应生成氧化铁,故该反应为:2Fe(OH)3
Fe2O3+3H2O.
故答案为:(1)NaOH;铜和铁的混合物;
(2)Fe+CuCl2═Cu+FeCl2;
(3)2NaOH+FeCl2=═Fe(OH)2↓+2NaCl;
(4)步骤②中是否产生气泡,如果产生气泡则说明A过量;
(5)2Fe(OH)3
Fe2O3+3H2O.
(2)根据(1)的分析可以知道加入过量A后所发生的反应为铁和氯化铜的反应,其化学方程式为:Fe+CuCl2═Cu+FeCl2;
(3)根可以知道步骤3中发生的反应为氢氧化钠和氯化亚铁的反应,即为:2NaOH+FeCl2=═Fe(OH)2↓+2NaCl;
(4)根据铁的性质可以知道,铁可以和稀盐酸反应生成气体,所以可以向固体甲中加入盐酸,如果铁过量,则会产生气体;
(5)根据铁给的信息可以知道氢氧化铁可以在加热的条件下反应生成氧化铁,故该反应为:2Fe(OH)3
| ||
故答案为:(1)NaOH;铜和铁的混合物;
(2)Fe+CuCl2═Cu+FeCl2;
(3)2NaOH+FeCl2=═Fe(OH)2↓+2NaCl;
(4)步骤②中是否产生气泡,如果产生气泡则说明A过量;
(5)2Fe(OH)3
| ||
点评:本题主要考查了对金属活动性顺序的应用以及酸碱盐的性质,根据反应是否发生判断物质的存在,培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目
 表示氢原子,
表示氢原子, 表示碳原子,
表示碳原子, 表示氧原子.请推断下列说法中正确的是( )
表示氧原子.请推断下列说法中正确的是( )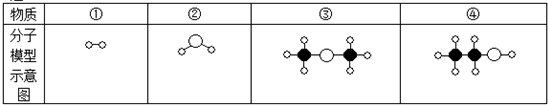
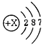 ,则X的值为
,则X的值为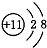 B、
B、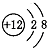 C、
C、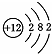 D、
D、