题目内容
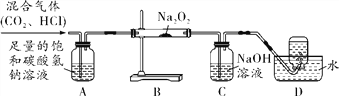
【题目】过氧化钠是钠与氧气反应的产物之一,过氧化钠与二氧化碳反应生成氧气,因此可用于航空航天或潜水艇中作供氧剂。某学习小组对过氧化钠的性质产生了浓厚的兴趣,他们设计了如图所示的实验装置进行探究。
【查阅资料】过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O发生反应:2Na2O2+2CO2=== 2Na2CO3+O2,2Na2O2+2H2O=== 4NaOH+O2↑。
结合下列装置回答:
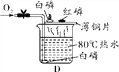
【提出问题】反应后硬质玻璃管中固体的成分是什么?
【作出猜想】猜想一:Na2CO3。
猜想二:NaOH。
猜想三:Na2CO3和NaOH。
猜想四:Na2CO3、NaOH和Na2O2。
【实验验证】实验一:小明同学取适量固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含________。
证明猜想四错误。
实验二:小刚同学取上述形成的溶液M于试管中,向其中加入过量的CaCl2溶液,观察到的实验现象为____________________,发生反应的化学方程式为 _______________ ,过滤,向滤液中滴加几滴酚酞溶液,滤液变红。证明猜想________成立。
【反思交流】①装置A的作用是__________________________________________。
②用D装置收集气体时的最佳时刻是______________________________________。
【拓展延伸】①小组中有同学认为,将实验二中加入的过量氯化钙溶液换成氢氧化钙溶液,也能得出同样的结论,你认为该同学的观点________(填“正确”或“错误”),理由是_________。
②在盛有氯化铵(NH4Cl)浓溶液的试管中,加入足量的过氧化钠(Na2O2)固体,有气泡产生,产生的气体是______________。
【答案】 过氧化钠(Na2O2) 有白色沉淀生成 CaCl2+Na2CO3=CaCO3↓+ 2NaCl 三 除去氯化氢气体 导管中的气泡连续均匀放出 错误 氢氧化钙会与碳酸钠反应产生白色沉淀和氢氧化钠,且氢氧化钙过量,过滤后向滤液中滴加几滴酚酞溶液,滤液变红,无法确定溶液中碱性物质是来自固体中氢氧化钠还是生成氢氧化钠还是过量的氢氧化钙,从而无法确定固体中含有氢氧化钠 氧气和氨气
【解析】本题考查了主要氢氧化钠和碳酸钠混合物的检验,先用中性盐溶液检验碳酸钠并完全除去碳酸钠,再检验氢氧化钠。
【实验验证】实验一:过氧化钠(Na2O2)能与H2O发生反应生成氧气,取适量固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含过氧化钠(Na2O2)。;
实验二:向其中加入足量氯化钙溶液,有白色沉淀生成,说明固体中含有碳酸钠,其化学方程式为:CaCl2+ Na2CO3=Ca CO3↓+ 2NaCl;、过滤后在滤液中滴加酚酞溶液,液体变为红色,说明固体中含有氢氧化钠,证明猜想三成立;
【反思交流】① NaHCO3能与HCl反应,不能与CO2反应,装置A的作用是除去氯化氢气体;
②导管中一开始放出的气体有玻璃管中的空气,等空气排出后,收集到的气体才较纯,用D装置收集气体时的最佳时刻是导管中的气泡连续均匀放出。
【拓展延伸】①如果将氯化钙溶液换成氢氧化钙溶液,不能得出相同的结论,氢氧化钙会与碳酸钠反应产生白色沉淀和氢氧化钠,且氢氧化钙过量,过滤后向滤液中滴加几滴酚酞溶液,滤液变红,无法确定溶液中碱性物质是来自固体中氢氧化钠还是生成氢氧化钠还是过量的氢氧化钙,从而无法确定固体中含有氢氧化钠;
②过氧化钠(Na2O2)能与H2O发生反应生成氧气和氢氧化钠,氢氧化钠与氯化铵反应生氯化钠和水和氨气,所以产生的气体为氧气和氨气。

 名校课堂系列答案
名校课堂系列答案