题目内容
【题目】学习酸碱中和反应时,很多同学对其产生了探究兴趣。
(1)甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,用手轻轻触摸试管外壁,感觉发烫,于是他得出“酸碱中和反应是放热反应”的结论,乙同学认为甲同学推理不合理,他的理由是_________________。
(2)乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化
如图所示:
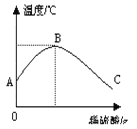
①由图知,稀硫酸与氢氧化钠溶液发生的反应是________(填“放热”或“吸热”)反应,B点表示的含义______________________。
②从A到B过程中,烧杯中溶液pH逐渐_____________。
③B到C的过程中,烧杯内溶液中含有的阳离子有(填离子符号)____________。
(3)为了测定所用稀硫酸中溶质的质量分数,做了以下实验:取50g这种稀硫酸,加入40g、20%的氢氧化钠溶液,两者恰好完全反应。试计算:①所用稀硫酸中溶质的质量分数。②反应后所得溶液中溶质的质量分数。
【答案】(1)氢氧化钠固体溶解于水时,也会放出热量
(2)①放热,稀硫酸与氢氧化钠溶液恰好完全反应②变小③Na+、H+
(3)H2SO4%=19.6%、Na2SO4%=15.8%
【解析】
试题分析:(1)因为氢氧化钠固体溶于水也会放出热量。
(2)①根据图象可以看出随着硫酸的加入,温度在逐渐的升高,故为放热;B点后温度降低,说明稀硫酸与氢氧化钠溶液恰好完全反应。②依题意,②稀硫酸慢慢滴入装有氢氧化钠溶液,故PH逐渐变小;③B到C的过程中,酸过量,故烧杯内溶液中含有的阳离子有Na+、H+。
(3)解:设所用稀硫酸中溶质的质量为x,反应后所得溶液中溶质的质量为y
H2SO4+2NaOH===Na2SO4+2H2O
98 80 142
x 40g×20% y
98/80=x/(40g×20%)x=9.8gH2SO4%=9.8g/50g×100%=19.6%
80/142=(40g×20%)/yy=14.2gNa2SO4%=14.2g/(50g+40g)×100%=15.8%
