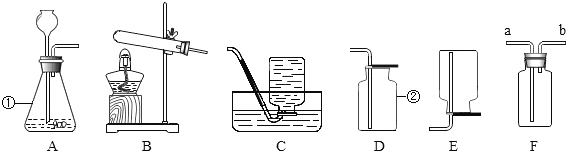
题目内容
【题目】(5分)“海水晒盐”所获得的粗盐中,除含有泥沙等难溶性杂质外,还含有氯化镁、氯化钙等可溶性杂质,某化学小组为得到较纯净的食盐,进行了下列实验探究活动,请参与他们的探究活动:
【提出问题】如何获得较纯的食盐晶体?
【查阅资料】20℃时,部分物质的溶解性情况如下表所示:
OH﹣ | CO32﹣ | |
Na+ | 溶 | 溶 |
Ca2+ | 微 | 不 |
Mg2+ | 不 | 微 |
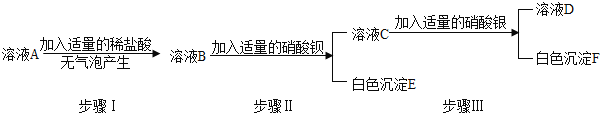
【实验方案】按如图方案进行提纯粗盐.
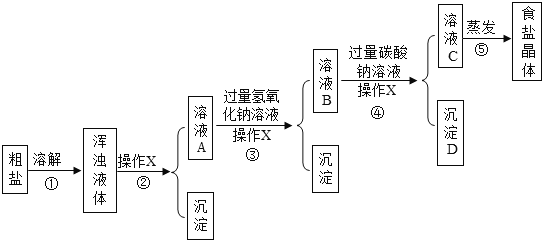
【解释与结论】
(1)操作X的名称是 .
(2)沉淀D是 .
(3)实验步骤③的主要目的是 (用化学方程式回答);
判断氢氧化钠溶液已过量的方法是 .
【反思与评价】
(4)有同学认为该实验方案并不完善,其理由及需补充的实验操作是 .
【答案】(1)过滤
(2)CaCO3
(3)MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaCl;取溶液B少量于试管中,滴加无色酚酞,变红色
(4)溶液C中还有过量的碳酸钠,应该加入适量的盐酸反应后再蒸发
【解析】
试题分析:①和②是溶解过滤,将不溶性的杂质除去;③MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaCl,再过滤,是将氯化镁除去;④CaCl2 + Na2CO3=CaCO3↓+ 2NaCl,再过滤,是将氯化钙除去;⑤是将水除去。
(1)固液分离,为过滤;
(2)CaCO3;
(3)MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaCl;即坚持氢氧根离子的存在,可以检测酸碱性等;
(4)即④可能加入过量的碳酸钠,可加入过量的盐酸除去,再利用盐酸的挥发性,蒸发除去水和HCl。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目