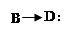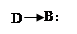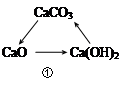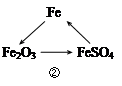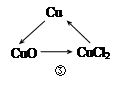��Ŀ����
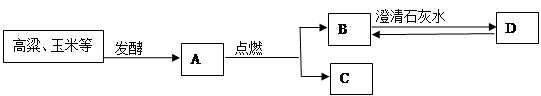
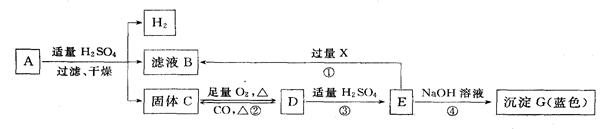
��ѧ���о����ú�ˮ���������շ����ж����������������£���ű�ʾ��ѧ��Ӧ����
 (1) д����Ӧ�ٵĻ�ѧ����ʽ ��
(1) д����Ӧ�ٵĻ�ѧ����ʽ ��
(2) SO2��CO2�Ļ�ѧ�������ơ�������������Һ����SO2ʱ������NaHSO3���������
��д��ѧʽ����
(3) ��Ӧ���з�����Ӧ�������� ��
(4)���к���������ķ���a g����������������Һ������պ�õ����������ƣ�������������b g��ͨ����������������ڷ����аٷֺ�����
 (1) д����Ӧ�ٵĻ�ѧ����ʽ ��
(1) д����Ӧ�ٵĻ�ѧ����ʽ ��(2) SO2��CO2�Ļ�ѧ�������ơ�������������Һ����SO2ʱ������NaHSO3���������
��д��ѧʽ����
(3) ��Ӧ���з�����Ӧ�������� ��
(4)���к���������ķ���a g����������������Һ������պ�õ����������ƣ�������������b g��ͨ����������������ڷ����аٷֺ�����
(1)2NaCl+2H2O  2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2����
(2) Na2SO3
(3) HSO3-��H+
(4)1.6b/ a ��100�G
 2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2����(2) Na2SO3
(3) HSO3-��H+
(4)1.6b/ a ��100�G
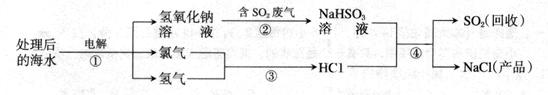
���������(1)���������֪��������ĺ�ˮ����Ҫ�����Ȼ��ƺ�ˮ���ʢ��еķ�Ӧ�����Ȼ��ƺ�ˮ�����ͼʾ��֪���������������������������ƣ��ʸ÷�Ӧ�Ļ�ѧ����ʽΪ2NaCl+2H2O
 2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2����(2)�������⣬SO2��CO2�Ļ�ѧ�������ƣ���������������Һ����SO2ʱ������NaHSO3���������Na2SO3����ΪCO2����NaOH��Һ��Ӧ����Na2CO3����SO2Ҳ����NaOH��Ӧ����Na2SO3��
(3)����ͼʾ��֪����Ӧ����NaHSO3��HCl��Ӧ����SO2��H2O��NaCl�Ĺ��̣��ʸ÷�Ӧ�Ļ�ѧ����ʽΪNaHSO3+HCl�TNaCl+H2O+SO2�����ɴ˿�֪���÷�Ӧ�з�����Ӧ��������HSO3-��H+��
(4)�������⣬��д��Ӧ�Ļ�ѧ����ʽ���������ĵ��������Ƶ�������������μӷ�Ӧ��SO2������������������������ڷ����еİٷֺ�����
�⣬������к���������xg
SO2 + NaOH = NaHSO3
64 40
x bg
64��40=x��bg
���x=1.6bg
����������ڷ����еİٷֺ���=
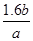 ��100�G
��100�G�𣺶��������ڷ����еİٷֺ���Ϊ
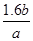 ��100�G��
��100�G����������ȷͼʾ�����ʵ�ת����ϵ����������������ʵ����ʣ��������Ǩ��Ӧ�ã��ǽ����Ĺؼ������ڷ���ʽ�ļ��㣬��������֪����δ֪��Ӧ�������������㼴�ɣ�ע��Ҫ�������ļ��㲽��淶����д��ʽ��

��ϰ��ϵ�д�
 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
�����Ŀ