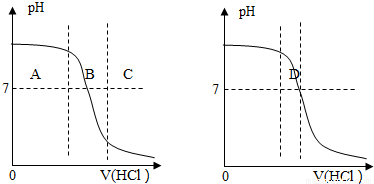
题目内容
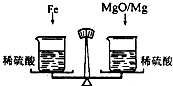 (2006?宜宾)在托盘天平的两盘上各放一只烧杯,分别盛有等质量、等质量分数的足量的稀硫酸,向左边烧杯中加入56g铁,向右边烧杯中加入58g镁和氧化镁的混合物,充分反应后天平保持平衡,则参加反应的铁与氧化镁中氧元素的质量比为
(2006?宜宾)在托盘天平的两盘上各放一只烧杯,分别盛有等质量、等质量分数的足量的稀硫酸,向左边烧杯中加入56g铁,向右边烧杯中加入58g镁和氧化镁的混合物,充分反应后天平保持平衡,则参加反应的铁与氧化镁中氧元素的质量比为14:1
14:1
.分析:根据酸足量,则金属完全反应,且天平仍然平衡,由加入固体的质量和生成的氢气的质量可知差量相等来代入化学反应方程式计算.
解答:解:金属完全反应,则设铁与酸反应的氢气质量为xg,
则Fe+H2SO4═FeSO4+H2↑
56 2
56g x
=
,解得x=2g
则推盘天平左边溶液增重为56g-2g=54g,
由天平后来还平衡,则右边溶液的增重也应为54g,设镁的质量为yg,
则Mg+H2SO4═MgSO4+H2↑ 增重△m
24 2 24-2=22
y
则由右边溶液的增重为54g,可知
(58-y)+
=54g
解得y=48g,
即58g镁和氧化镁的混合物中镁的质量为48g,
则氧化镁的质量为58g-48g=10g,
氧化镁中氧元素的质量为10g×
×100%=4g,
则参加反应的铁与氧化镁中氧元素的质量比为56g:4g=14:1,
故答案为:14:1.
则Fe+H2SO4═FeSO4+H2↑
56 2
56g x
| 56 |
| 56g |
| 2 |
| x |
则推盘天平左边溶液增重为56g-2g=54g,
由天平后来还平衡,则右边溶液的增重也应为54g,设镁的质量为yg,
则Mg+H2SO4═MgSO4+H2↑ 增重△m
24 2 24-2=22
y
| 22y |
| 24 |
则由右边溶液的增重为54g,可知
(58-y)+
| 22y |
| 24 |
解得y=48g,
即58g镁和氧化镁的混合物中镁的质量为48g,
则氧化镁的质量为58g-48g=10g,
氧化镁中氧元素的质量为10g×
| 16 |
| 24+16 |
则参加反应的铁与氧化镁中氧元素的质量比为56g:4g=14:1,
故答案为:14:1.
点评:本题较难,考查学生利用化学反应方程式分析天平平衡的问题,明确固体的质量不同,学生能利用差量法来计算是解答的关键.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目