题目内容
小明设计实验探究铁、铜、银三种金属的活动性顺序。他设计了四个实验方案,分别选择的试剂是:①铜、银、硫酸亚铁溶液;② 铁、银、硫酸铜溶液 ;③银、硫酸亚铁溶液、硫酸铜溶液 ;④铜、硫酸亚铁溶液、硝酸银溶液 。上述四个方案所选试剂正确的是
| A.②④ | B.①②③ | C.①②③④ | D.②③ |
A
解析试题分析:根据三种金属的活动性顺序(铁、铜、银)可知:①铜、银均不和硫酸亚铁溶液发生反应,不能说明铜银的活动性强弱;此项不正确。② 铁与硫酸铜溶液反应可说明铁的活动性要大于铜;银与硫酸铜溶液不反应可说明银的活动性要小于铜;此项正确。③银和硫酸亚铁溶液、硫酸铜溶液均不反应,可说明银的活动性最弱,但无法说明铁和铜的活动性顺序;此项不正确。④铜和硫酸亚铁溶液不反应,铜可与硝酸银溶液反应可说明银的活动性要小于铜;此项正确。所以应选A项。
考点:金属活动性顺序

现在全国上下正在创建节约型、创新型的和谐社会.信息技术日新月异,大量的计算机被更新换代,许多的废旧计算机搁置在回收公司.废旧计算机的某些零部件含有锌、铁、铜、银、铂、金等金属,经物理方法初步分析后,加入足量的稀盐酸充分反应,过滤所得的固体中不可能含有的金属是( )
| A.铜、银 | B.锌、铁 | C.铜、铂 | D.银、金 |
若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是( )
| A.Mn+2HCl =MnC12+H2↑ |
| B.Mg +MnSO4= MgSO4+Mn |
| C.Mn+Cu(NO3)2=Mn(NO3)2+Cu |
| D.Fe+MnSO4 =FeSO4+Mn |
小明为探究金属与盐的反应,将一定质量的某种金属 M 的粉末放入 AgNO3与 Cu(NO3)2的混合溶液中,充分反应后发现,溶液呈现无色,溶液底部有少量固体粉末;过滤后在滤渣中加入适量稀盐酸,有无色气体产生。结合实际现象判断,小明得出的以下结论错误的是
| A.滤液中一定没有银离子 | B.滤渣中一定含有金属单质 M |
| C.滤渣中一定含有单质铜 | D.加入的金属 M 可能是单质铁 |
往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是( )
| A.滤液中一定有Cu2+、Fe2+ | B.滤液中一定有Ag+、Cu2+ |
| C.滤液中一定有Fe2+ | D.滤渣中一定有_____________ |
向一定质量AgNO3和Cu (NO3)2的混合溶液中加入Zn粉,溶液质量与加入Zn粉的质量关系如图所示。下列说法错误的是
| A.a点溶液中的溶质有3种 |
| B.若取b~c段溶液,滴加稀盐酸,无白色沉淀 |
| C.取c点的固体,加入稀盐酸,有气泡产生 |
| D.d点溶液中溶质为Zn(NO3)2 |
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )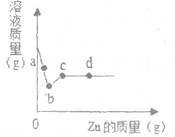
| A.a点溶液中的溶质有2种 |
| B.c点溶液中溶质为Zn(NO3)2 |
| C.若取b~c段溶液,滴加稀盐酸,有白色沉淀 |
| D.取d点的固体,加入稀盐酸,无气泡产生 |
 nCaSO4
nCaSO4