题目内容
【题目】实验室常用燃烧的方法测定有机物的组成.现取3.2g某有机物在足量氧气中充分燃烧,生成4.4g二氧化碳和3.6g水,则该有机物中( )
A.一定含有C,H两种元素,可能含有O元素
B.一定含有C,H,O三种元素
C.只含有C,H两种元素,不含有O元素
D.C,H两种元素质量比为11:9
【答案】B
【解析】解:根据质量守恒定律,反应后生成的二氧化碳中碳元素的质量就是有机物中碳元素的质量,生成的水中氢元素的质量就是有机物中氢元素的质量.故该有机物中含有C的质量为:4.4g× ![]() =1.2g;该有机物中含有H的质量为:3.6g×
=1.2g;该有机物中含有H的质量为:3.6g× ![]() =0.4g;该有机物中含有O的质量为:3.2g﹣1.2g﹣0.4g=1.6g.因此可判断该有机物中含有C、H、O三种元素.
=0.4g;该有机物中含有O的质量为:3.2g﹣1.2g﹣0.4g=1.6g.因此可判断该有机物中含有C、H、O三种元素.
故选B.
根据质量守恒定律解答本题.根据生成二氧化碳的质量和二氧化碳中碳元素的质量分数,计算出该有机物中含有C的质量,同理,根据生成水的质量和H2O中氢元素的质量分数,计算出该有机物中含有H的质量,再根据质量守恒定律,反应前该有机物质量减去C、H的质量,就是其含有O的质量,据此即可判断该有机物中含有的元素.

【题目】实验是科学探究的重要方法,如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题. 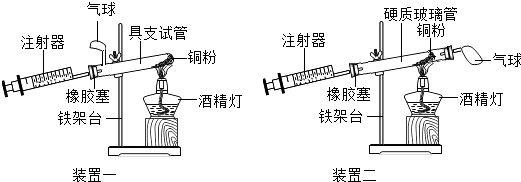
(1)根据下表提供的实验数据,完成下表.
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
25mL | 15mL | 9mL |
(2)装置一和装置二中气球的位置不同,(填“装置一”或“装置二”)更合理,理由是 .
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条)、 .
【题目】小玲学习了用pH试纸测定溶液pH的方法后,收集了家里几种物质进行测定,结果如下:
物质 | 厕所清洁剂 | 牙膏 | 肥皂 | 厨房清洁剂 |
pH | 2 | 8 | 10 | 12 |
上述物质中,最容易腐蚀铁制下水管道的是( )
A.厕所清洁剂
B.牙膏
C.肥皂
D.厨房清洁剂