题目内容
请根据下列实验和溶解度曲线图1回答问题:(已知水的密度约为1g/cm3)
(1)③中溶液的质量为______g;一定属于不饱和溶液的是______(填序号,下同);溶质的质量分数一定相等的是______.
(2)析出晶体的质量为______.
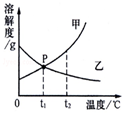
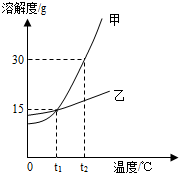
(3)(如图2)甲物质的溶液分别处于a、b、c、d四个点时,溶液中甲的质量分数大小关系正确的是______(选填下列编号).
A.c>d=b>aB.c=d>a=bC.c>a>b=dC.c>a=b>d.

| 实验操作 | 实验结果 |
| 取100mL水,加入25gKNO3,搅拌,恢复至20℃ | 全部溶解,得溶液① |
| 再加wg硝酸钾,搅拌,恢复至20℃ | 恰好饱和,得溶液② |
| 再加25g硝酸钾,搅拌,恢复至20℃ | 得溶液③ |
| 加热 | 全部溶解,得溶液④ |
| 冷却至20℃ | 析出晶体,得溶液⑤ |
(2)析出晶体的质量为______.
(3)(如图2)甲物质的溶液分别处于a、b、c、d四个点时,溶液中甲的质量分数大小关系正确的是______(选填下列编号).
A.c>d=b>aB.c=d>a=bC.c>a>b=dC.c>a=b>d.

(1)水的密度为1g/cm3,根据溶液的质量=溶液的密度×溶液的体积,则100mL水的质量为100g;20℃时,硝酸钾的溶解度为31.6g,故取100mL水,加入25g硝酸钾,搅拌,恢复至20°C,所得溶液①为不饱和溶液;
再加wg硝酸钾,搅拌,恢复至20°C,恰好饱和,所得溶液②,为饱和溶液;再加25g硝酸钾,搅拌,恢复至20°C,硝酸钾不能继续溶解,故所得溶液③为饱和溶液;③中饱和溶液的质量为131.6g;加热后,全部溶解,溶液④可能恰好饱和,也可能为不饱和溶液;冷却至20°C,有晶体析出,故所得溶液⑤为饱和溶液;
(2)加热后100mL水中共溶解了(31.6g+25g)硝酸钾,而20℃时,硝酸钾的溶解度为31.6g,故降温后析出晶体的质量为25g;
(3)由图2可知甲的溶解度随温度的升高而增大,同一温度下溶解度相等,饱和溶液的溶质质量分数大于不饱和溶液;t2℃时甲的溶解度大于t1℃时甲的溶解度,饱和溶液甲从t2℃时降低温度到t1℃时,饱和溶液的溶质质量分数减小,t2℃时饱和溶液的溶质质量分数大于于t1℃时饱和溶液的溶质质量分数,故答案c>a>b=d;
故答案为:
(1)131.6g;①;②③⑤;
(2)25;
(3)C.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目