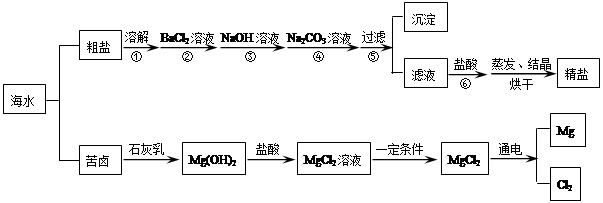题目内容
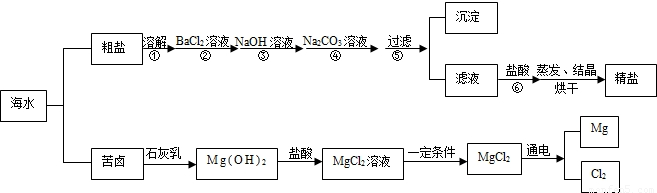
(2009?青岛)海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图:

(1)在苦卤制镁的过程中加入了石灰乳(主要成分是氢氧化钙),石灰乳是用生石灰制得的,请写出制取石灰乳的化学方程式
(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒
(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是

(1)在苦卤制镁的过程中加入了石灰乳(主要成分是氢氧化钙),石灰乳是用生石灰制得的,请写出制取石灰乳的化学方程式
CaO+H2O═Ca(OH)2
CaO+H2O═Ca(OH)2
.(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒
不可以
不可以
,理由是碳酸钠作用是既除去Ca2+,又除去多余的氯化钡
碳酸钠作用是既除去Ca2+,又除去多余的氯化钡
;(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是
除去多余的氢氧化钠和碳酸钠
除去多余的氢氧化钠和碳酸钠
.分析:(1)根据反应物和生成物及其质量守恒定律可以书写化学方程式;
(2)碳酸钠作用是既除去Ca2+,又除去多余的氯化钡;
(3)盐酸能和氢氧化钠反应生成氯化钠和水,能和碳酸钠反应生成氯化钠、水和二氧化碳.
(2)碳酸钠作用是既除去Ca2+,又除去多余的氯化钡;
(3)盐酸能和氢氧化钠反应生成氯化钠和水,能和碳酸钠反应生成氯化钠、水和二氧化碳.
解答:解:(1)氧化钙和水反应的化学方程式为:CaO+H2O═Ca(OH)2.
(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序不可以颠倒,因为碳酸钠的作用是既除去Ca2+,又除去多余的氯化钡.故填:不可以;碳酸钠作用是既除去Ca2+,又除去多余的氯化钡.
(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是除去多余的氢氧化钠和碳酸钠.故填:除去多余的氢氧化钠和碳酸钠.
(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序不可以颠倒,因为碳酸钠的作用是既除去Ca2+,又除去多余的氯化钡.故填:不可以;碳酸钠作用是既除去Ca2+,又除去多余的氯化钡.
(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是除去多余的氢氧化钠和碳酸钠.故填:除去多余的氢氧化钠和碳酸钠.
点评:解答本题要能够正确的书写化学方程式,要理解除去杂质过程中各种物质的作用,特别应该注意加入试剂的顺序.

练习册系列答案
相关题目