题目内容
(2012?保山)将下列四种家庭常用的调味品分别放入水中,不能形成溶液的是( )
分析:一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的基本特征是均一性和稳定性;只有被分散的物质在另一种物质中是可溶的,二者混合后才会形成溶液.
解答:解:A、白醋易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
B、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
C、味精易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
D、食用油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项正确.
故选D.
B、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
C、味精易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
D、食用油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项正确.
故选D.
点评:本题难度不大,掌握溶液的本质特征、各种物质的水溶性方面的知识是解答本题的关键.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
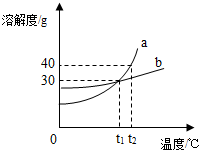 (2012?保山)如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
(2012?保山)如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )