题目内容
【题目】地质考察人员发现一种带螺纹的矿石,研究时发现该矿石能在氧气中燃烧,主要反应是4X+11O2![]() 2Fe2O3+8SO2。下列有关说法中不正确的是
2Fe2O3+8SO2。下列有关说法中不正确的是
A.X的化学式是FeS2
B.SO2中的硫、氧元素的个数比为1:2
C.反应前后氧元素的化合价发生改变
D.Fe2O3中铁元素的质量分数为70%
【答案】B
【解析】
试题分析:A、由4X+11O2![]() 2Fe2O3+8SO2可知,每个X中含有1个铁原子和2个硫原子,是二硫化亚铁,化学式是FeS2,正确;B、应表诉为SO2中的硫、氧原子的个数比为1:2,元素宏观概念无个数表诉,错误; C、反应前氧元素组成单质,化合价为0,反应后氧元素分别与硫元素、铁元素组成化合物,化合价为-2,正确; D、Fe2O3中铁元素的质量分数= (56×2)/[(56×2)+(16×3)]×100%=70%,正确。
2Fe2O3+8SO2可知,每个X中含有1个铁原子和2个硫原子,是二硫化亚铁,化学式是FeS2,正确;B、应表诉为SO2中的硫、氧原子的个数比为1:2,元素宏观概念无个数表诉,错误; C、反应前氧元素组成单质,化合价为0,反应后氧元素分别与硫元素、铁元素组成化合物,化合价为-2,正确; D、Fe2O3中铁元素的质量分数= (56×2)/[(56×2)+(16×3)]×100%=70%,正确。

 天天练口算系列答案
天天练口算系列答案【题目】咱们学校化学兴趣小组的同学,对实验室制备氧气的若干问题进行如下探究:
(一)为探究影响双氧水分解速度的某种因素,A小组记录了如下实验数据:
双氧水的质量 | 双氧水的浓度 | MnO2的质量[来源:] | 相同时间内产生O2的体积 | |
I | 50.0g | 1% | 0.1g | 9mL |
II | 50.0g | 2% | 0.1g | 16mL |
III | 50.0g | 4% | 0.1g | 31mL |
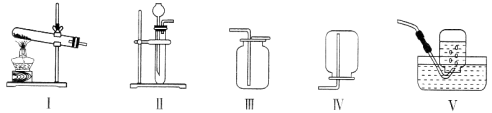
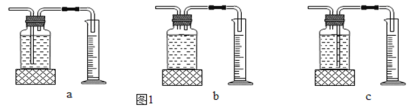
(1)本实验中,测量O2体积的装置是 (选填下图1中的装置编号)。
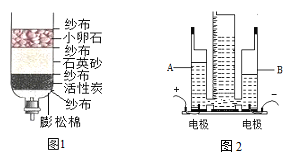
(2)实验结论:在相同条件下, ,双氧水分解速率越快。
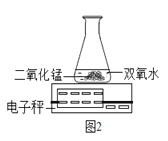
(3)B小组用如图2装置进行实验,则该变化的化学反应方程式为 ,通过比较也能达到实验目的。
(二)C小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂。
于是他们用天平称量0.2g氧化铜,取5mL5%过氧化氢溶液于试管中,进行如下实验:
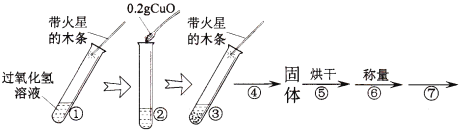
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦操作 | 结论 |
,带火星的木条复燃; | ; | 将固体加入盛有5mL5%过氧化氢溶液的试管中,并把带火星的木条伸入试管,观察现象。 | 在过氧化氢溶液的分解反应中,氧化铜也能作催化剂。 |
(2)步骤①的目的是 ,
(3)步骤④对应的实验操作是 ,
(4)步骤⑦是证明 。
(三)D小组为探究催化剂的种类对氯酸钾分解速度的影响,设计了以下对比实验:
a.将12.25g KClO3与5.0g MnO2均匀混合加热
b.将12.25g KClO3与5.0g CuO均匀混合加热
(1)在相同温度下,比较两组实验产生O2的快慢。通常采用的方法有:
①测相同时间内产生O2的体积;②测 。
(2)计算:12.25g KClO3中所含氧元素质量与 克过氧化氢中所含氧元素的质量相等?