题目内容
【题目】近期国家有关部门组织了“食品安全在行动”的活动。下列做法符合食品安全理念的是
A. 在牛奶中加适量乳酸钙,帮助饮用者补充钙元素
B. 为保持肉制品鲜美,在香肠中加过量的亚硝敞钠
C. 为提高牛奶的含氮量,向牛奶中添加三聚氰胺
D. 为让失击原色的粽叶返青,用硫酸铜溶液浸泡粽叶
【答案】A
【解析】
A、乳酸钙中含有可吸收的钙元素,故在牛奶中加入适量乳酸钙,能帮助饮用者补充钙元素,所以正确;
B、亚硝酸钠有毒,不能食用,所以错误;
C、三聚氰胺有毒,可以致癌,不能用于食品添加剂,所以错误;
D、硫酸铜溶液能电离出有毒的重金属离子--铜离子,它能破坏人体蛋白质的结构,使之失去生理功能,不能食用,所以错误。
故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】白云石粉是一种生产高级玻璃器皿、医药用瓶、光学玻璃的原料,某化学兴趣小组对白云石粉极其好奇,决定对其进行探究。
【查阅资料】白云石属于碳酸盐矿物,白云石粉主要成分的化学式可表示为:xMgCO3 · yCaCO3。(杂质是二氧化硅,其不溶于水,也不与盐酸反应,受热不分解)一、定性探究:白云石粉的成分和性质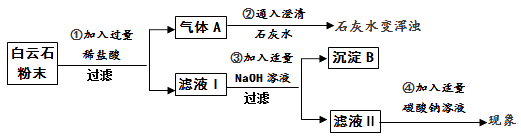
【实验分析】
(1)过滤操作中用到的玻璃仪器有玻璃棒、烧杯、。
(2)由步骤①②的现象可得出白云石粉中一定含有的离子是(填离子符号)。
(3)步骤③生成氢氧化镁的化学方程式是 。步骤④的反应现象是。
【结论】综合上述实验现象可初步证明白云石由碳酸钙、碳酸镁组成。
【实验质疑】小组同学经过讨论认为:因氢氧化钙微溶于水,导致沉淀B中除了氢氧化镁之外应该还混有氢氧化钙,对定量测定白云石粉的组成干扰较大,在老师的指导下该兴趣小组采用热分解法进行定量探究。
(4)二、定量探究:白云石的组成
【查阅资料】碳酸钙开始分解的温度为898℃,1000℃时完全分解生成生石灰和二氧化碳气体;碳酸钙与碳酸镁的化学性质相似;碳酸镁开始分解的温度为540℃,700℃时完全分解。
【实验设计】为测定白云石中的含钙量及x:y的值,该兴趣小组设计了如下装置并进行实验: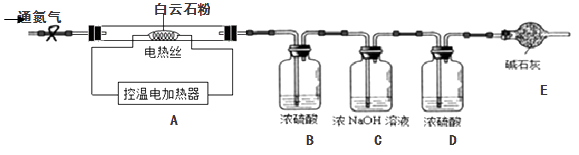
【实验步骤】①组装仪器,检查装置的气密性;②准确称取15.0g白云石粉末放在A装置中,打开弹簧夹,鼓入一段时间氮气,称量B、C、D装置的质量;③关闭弹簧夹,打开控温电加热器,缓缓调升温度至700℃,持续加热至固体质量不变;④打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D装置的质量;⑤关闭弹簧夹,调升温度至1000℃,持续加热至固体质量不变,打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D装置的质量。
实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | |
反应前 | 50.0 | 100.0 | 50.0 |
700℃ | 50.0 | 102.1 | 50.1 |
1000℃ | 50.0 | 106.3 | 50.3 |
【实验分析和数据处理】
装置D的作用是;
(5)持续加热至固体质量不变后缓缓鼓入一段时间氮气的目的是。
(6)计算白云石中钙元素的质量分数。(写出计算过程,结果保留小数点后一位):、
(7)设计实验证明白云石粉已完全分解的实验方法是(写出实验方法、现象、结论)
(8)白云石(xMgCO3 · yCaCO3)中的x:y=(最简整数比),若加热前没有鼓入一段时间的氮气,将会导致x:y的值(填偏大、偏小或不变)。