��Ŀ����
����Ŀ�����������������������������أ��ι����ս�����֪ʶ�dz���Ҫ��
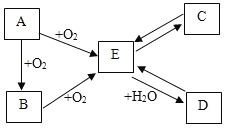
��1���������������������г����Ľ���������������ʴ����Ϊ_____��
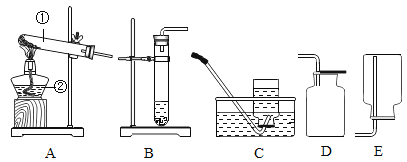
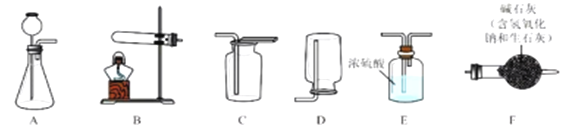
��2��ʵ����ģ��������ʵ������ͼ��
����ͼA�е�ʵ��������_____��
��B�Թ��з�����Ӧ�Ļ�ѧ����ʽ��_____��
��ʵ�鿪ʼʱӦ��ͨ��һ����̼����ȣ���������Ŀ����_____��
��3������Ʒ������ʴ��������_____ͬʱ��Ӧ�Ľ����
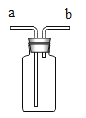
��4��ij��ѧС����һ����![]() ��
��![]() �Ļ����Һ��������ͼʵ�飬��������ϵμ�����ʱ�����ݲ���������Һ����һ�����е�������_____��д��ѧʽ������д��һ����ʵ���������������Ӧ�Ļ�ѧ����ʽ_____��
�Ļ����Һ��������ͼʵ�飬��������ϵμ�����ʱ�����ݲ���������Һ����һ�����е�������_____��д��ѧʽ������д��һ����ʵ���������������Ӧ�Ļ�ѧ����ʽ_____��
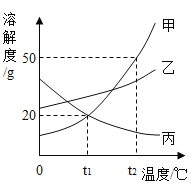
��5��ʵ����������һ����̼��ԭ20 g������ַ�Ӧ������ɶ�����̼������Ϊ![]() ����ó������������������������Ƕ��٣�_____
����ó������������������������Ƕ��٣�_____
���𰸡����Ϳ����е�����������Ӧ�������γ�һ�����ܵ���������Ĥ����ֹ���һ�������� ��ɫ��ĩ��ɺ�ɫ ![]() �ų���������ֹ�ڼ���ʱ������ը ����
�ų���������ֹ�ڼ���ʱ������ը ����![]() ��ˮ
��ˮ![]() ������������п
������������п ![]() ��
��![]() 80%
80%
��������
��1���������Ϳ����е�������Ӧ�������ܵ�����Ĥ��ֹ���������ĽӴ�����ֹ��Ӧ�Ľ��У���������������ʴ��
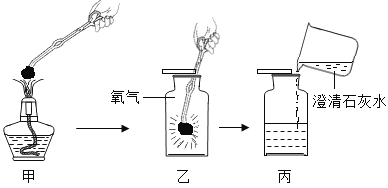
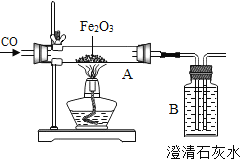
��2����ͼA�У�һ����̼����������Ӧ�������Ͷ�����̼����Ӧ�����Ǻ�ɫ��ĩ��ɺ�ɫ��
��B�Թ��У��Ƕ�����̼���������Ʒ�Ӧ����̼��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽ��
![]() ��
��
��ʵ�鿪ʼʱӦ��ͨ��һ����̼����ȣ���������Ŀ�����ſ�װ���ڵ��������߿�
����ֹ������ը��
��3������Ʒ������ʴ��������������ˮͬʱ��Ӧ�Ľ����
��4��![]() ��
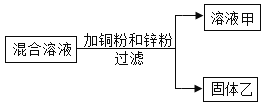
��![]() �Ļ����Һ����ͭ��п��п������������Ӧ��ֻ����������Ӧ����п��ȫ��Ӧ��ͭ���ܺ���������Ӧ����������ϵμ�����ʱ�����ݲ�����˵��п��ʣ�࣬��ͭ�����뷴Ӧ������������ȫ��Ӧ��������Һ����һ�����е�������������������п�������з�����п���������ķ�Ӧ��п������ķ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ
�Ļ����Һ����ͭ��п��п������������Ӧ��ֻ����������Ӧ����п��ȫ��Ӧ��ͭ���ܺ���������Ӧ����������ϵμ�����ʱ�����ݲ�����˵��п��ʣ�࣬��ͭ�����뷴Ӧ������������ȫ��Ӧ��������Һ����һ�����е�������������������п�������з�����п���������ķ�Ӧ��п������ķ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ![]() ��
��![]() ��
��
��5����ó�����������������������Ϊx
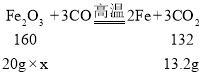
![]()
x=80%
�������������������������80%��

����Ŀ���ҹ�������ѧ�Һ�°����������ˡ������Ƽ������ԭ������Ҫ��һ������ʳ��ˮ���Ⱥ�ͨ������NH3��CO2�Ʊ�NaHCO3����ѧ����ʽ��NaCl+ NH3+CO2+H2O= NaHCO3��+NH4Cl
ij��ȤС����ʵ����ģ��ù��̣����Ͼ���IJ���ش��������⣺
I�������Ʊ�
��1��������̼�����Ʊ�
ʵ���ҳ�����ʯ��ʯ��ϡ���ᷴӦ�Ʊ�CO2���仯ѧ����ʽΪ_____________��Ӧѡ��������ռ�װ��Ϊ______(ѡ��װ�ö�Ӧ����ĸ)��
��2�������Ʊ�
ʵ���ҳ����������հ�������ֹ��Ⱦ������ʵ�����Ʊ�NH3�ķ�Ӧԭ��Ϊ��Ca(OH)2(��)+2NH4Cl(��) ![]() CaCl2+2H2O+2NH3������Ҫ�Ʊ�������NH3����ѡװ�õ���ȷ����˳��Ϊ_____��______(ѡ��װ�ö�Ӧ����ĸ)��ʵ�����Ʊ�O2Ҳ���������Ʊ�NH3�ķ���װ�ã�д���ø÷���װ���Ʊ�O2�Ļ�ѧ����ʽ__________��
CaCl2+2H2O+2NH3������Ҫ�Ʊ�������NH3����ѡװ�õ���ȷ����˳��Ϊ_____��______(ѡ��װ�ö�Ӧ����ĸ)��ʵ�����Ʊ�O2Ҳ���������Ʊ�NH3�ķ���װ�ã�д���ø÷���װ���Ʊ�O2�Ļ�ѧ����ʽ__________��
II��NaHCO3�Ʊ�
���� | NaHCO3 | NH4Cl |
�ܽ��/g(20��) | 9.6 | 37.2 |
��3�����ݱ����е��ܽ�����ݣ�����20��������NaHCO3�ܹ��ȴ���Һ�нᾧ������ԭ��________��
��4���ù�������һ����NH4Cl��ũҵ�����г�������______________��