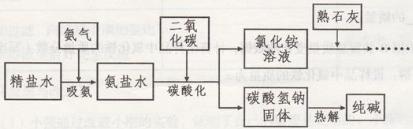
题目内容
海水是一种取之不尽、用之不竭的资源宝库.请围绕科学利用海水资源,填写空格:
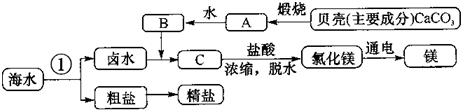
(1)从海水中获取淡水.常用的操作方法是
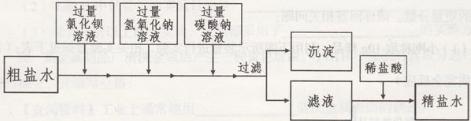
(2)通过操作①可以从海水中获得粗盐,操作①为
(3)从海水中得到金属镁.上述过程中,B生成试剂C,C和盐酸发生的是中和反应,则C的化学式为
整个过程中没有涉及的基本反应类型是

(1)从海水中获取淡水.常用的操作方法是
蒸馏
蒸馏
;(2)通过操作①可以从海水中获得粗盐,操作①为
蒸发
蒸发
.(3)从海水中得到金属镁.上述过程中,B生成试剂C,C和盐酸发生的是中和反应,则C的化学式为
Mg(OH)2
Mg(OH)2
;由无水MgCl2制取Mg的化学方程式为MgCl2
Mg+Cl2↑
| ||
MgCl2
Mg+Cl2↑
.
| ||
整个过程中没有涉及的基本反应类型是
置换反应
置换反应
.分析:(1)根据蒸馏的原理回答;
(2)根据氯化钠的溶解度受温度影响不大的特点回答前一空;
(3)根据图中的流程结合所学的酸碱盐的有关知识、化学方程式的书写以及基本反应类型的判断分析.
(2)根据氯化钠的溶解度受温度影响不大的特点回答前一空;
(3)根据图中的流程结合所学的酸碱盐的有关知识、化学方程式的书写以及基本反应类型的判断分析.
解答:解:(1)从海水中获取淡水,是除去水中可溶性杂质的过程,水蒸发可变成水蒸气,然后再凝结可形成水,而海水中溶解的可溶性杂质只会留在母液中,所以可用蒸馏法;
(2)氯化钠的溶解度受温度影响不大,改变温度不易出,所以用蒸发的方法;
(3)B生成试剂C,C和盐酸发生中和反应生成氯化镁,则C应是氢氧化镁,化学式为:Mg(OH)2;根据信息,由无水MgCl2制取Mg是分解反应,条件是通电,生成物中有镁,根据质量守恒定律,还应有氯气,方程式为:MgCl2
Mg+Cl2↑;
碳酸钙高温煅烧和氯化镁通电分解属于分解反应;A氧化钙和水反应生成氢氧化钙属于化合反应;卤水中的氯化镁和B氢氧化钙反应、C氢氧化镁和盐酸都属于复分解反应,因此整个过程中没有涉及的基本反应类型是置换反应;
故答案为:(1)蒸馏;(2)蒸发;(3)Mg(OH)2;MgCl2
Mg+Cl2↑;置换反应.
(2)氯化钠的溶解度受温度影响不大,改变温度不易出,所以用蒸发的方法;
(3)B生成试剂C,C和盐酸发生中和反应生成氯化镁,则C应是氢氧化镁,化学式为:Mg(OH)2;根据信息,由无水MgCl2制取Mg是分解反应,条件是通电,生成物中有镁,根据质量守恒定律,还应有氯气,方程式为:MgCl2
| ||
碳酸钙高温煅烧和氯化镁通电分解属于分解反应;A氧化钙和水反应生成氢氧化钙属于化合反应;卤水中的氯化镁和B氢氧化钙反应、C氢氧化镁和盐酸都属于复分解反应,因此整个过程中没有涉及的基本反应类型是置换反应;
故答案为:(1)蒸馏;(2)蒸发;(3)Mg(OH)2;MgCl2
| ||
点评:解答本题要掌握化学方程式的书写方法和淡化海水方面的知识,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目