题目内容
【题目】某同学在实验室发现一瓶敞口放置的NaOH固体后,对这瓶NaOH固体变质情况进行了如下实验探究(氯化钙溶液呈中性)。设计方案如下:

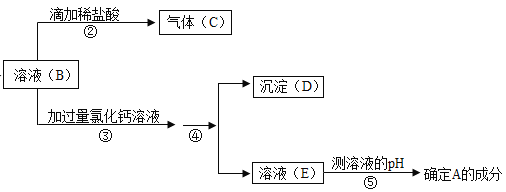
回答下列问题,
(1)上述实验操作的名称分分别是,操作①_____,操作④_____。
(2)根据上述实验,可以确定该固体_____变质(填“已”或“未”)
(3)步骤③中加过量氯化钙溶液的目的是_____。
(4)若测得E的pH=7,则A的成分_____,若测得E的pH>7,则A的成分_____。
(5)写出溶液B与氯化钙溶液反应的化学方程式_____。
【答案】溶解 过滤 已 除尽溶液中的碳酸钠 碳酸钠 碳酸钠和氢氧化钠 CaCl2+Na2CO3=CaCO3↓+2NaCl
【解析】
(1)操作①是将固体加水变成溶液,故操作是:溶解;
操作④是将难溶性的固体和液体分离,故操作是:过滤;
(2)②中滴加稀盐酸产生气体,是碳酸钠和盐酸反应产生的二氧化碳,因此可以判断有碳酸钠的存在,所以氢氧化钠固体已经发生变质;故答案为;已;
(3)为探究固体中是否还含有NaOH,由于碳酸钠溶液也显碱性,故要先排除碳酸钠的干扰;因此过量的CaCl2溶液可将碳酸钠全部反应掉,滴加足量的CaCl2溶液目的是:除尽溶液中的碳酸钠;
(4)因为碳酸钠和过量的氯化钙反应产生碳酸钙沉淀和氯化钠,碳酸钠已被除尽,若测定溶液的pH=7,说明溶液中没有氢氧化钠,氢氧化钠是完全变质成碳酸钠;若pH>7,说明溶液中还有氢氧化钠,氢氧化钠是部分变质,A的成分含有未变质的氢氧化钠和已经变质的碳酸钠;故答案为:碳酸钠;碳酸钠和氢氧化钠;
(5)足量的CaCl2溶液可将碳酸钠全部反应掉,反应产生碳酸钙沉淀和氯化钠,故反应的方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl。

练习册系列答案
相关题目