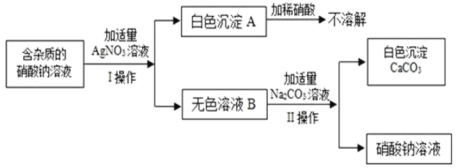
题目内容
【题目】实验室用大理石与稀盐酸反应制取二氧化碳。请回答相关问题。
(1)用36.5%的浓盐酸配制100g质量分数为14.6%的稀盐酸,需要加入__________mL水(水的密度1g/cm3)。
(2)向12g大理石中加入50g 14.6%的稀盐酸充分反应后,不再有气泡产生,求:
①最终产生的二氧化碳的质量是多少__________?
②大理石中碳酸钙的质量分数_____________(计算结果精确到小数点后一位)(写出计算过程)
【答案】 60。 4.4 83.3%
【解析】本题考查了根据化学方程式计算和有关溶液稀释的计算。
(1)设:需要加入水的质量为x。
根据溶液在稀释前后,溶质的质量不变,则有:100g×14.6%=(100g-x)×36.5%,x=60g,水的体积=60mL;
(2)设:产生的二氧化碳的质量为y,大理石中碳酸钙的质量为z。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
z 50g×14.6% y
![]() z=10g
z=10g
![]() y=4.4g
y=4.4g
大理石中碳酸钙的质量分数=![]() ×100%=88.3%。
×100%=88.3%。
答:(1)需要加入60mL水。
(2)①最终产生的二氧化碳的质量是多少4.4g。
②大理石中碳酸钙的质量分数为88.3%。

【题目】金属钛![]() 是
是![]() 世纪最重要的金属之一.某化学兴趣小组的同学为探究铝、铜、钛的金属活动顺序,做了如下实验:①先用砂布将金属表面擦光亮.②将大小、厚薄相同的三种金属片分别放入到盛有相同体积的同种盐酸的试管中,观察到的现象如下:
世纪最重要的金属之一.某化学兴趣小组的同学为探究铝、铜、钛的金属活动顺序,做了如下实验:①先用砂布将金属表面擦光亮.②将大小、厚薄相同的三种金属片分别放入到盛有相同体积的同种盐酸的试管中,观察到的现象如下:
金属 | 钛 | 铝 | 铜 |
与盐酸反应的现象 | 放出气泡缓慢 | 放出气泡快 | 无现象 |
![]() 依据上表现象推断三种金属的活动性顺序从强到弱为:________,把金属钛放在硫酸铜溶液中能否发生反应?________(填“能”或“不能”);
依据上表现象推断三种金属的活动性顺序从强到弱为:________,把金属钛放在硫酸铜溶液中能否发生反应?________(填“能”或“不能”);
![]() 根据三种金属的性质和用途回答:①建筑常用铝合金做门窗,原因是________(答
根据三种金属的性质和用途回答:①建筑常用铝合金做门窗,原因是________(答![]() 点);
点);